Сразу после добавления анилина сигнал ОН-протона салицилового альдегида исчезает вследствие уширения линии, вызванного химическим обменом с NН2-протонами анилина, сигнал СН-протона альдегида постепенно уменьшается и растет сигнал СН-протона основания Шиффа. Считая, что ширины линий одинаковы, можно измерить константу скорости реакции из графической зависимости.
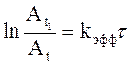 ,
,
где
![]() – амплитуда сигнала СН-салицилового
альдегида в момент времени t1, принимаемый
за начальный, Аt – амплитуда этого сигнала в
момент времени t,
– амплитуда сигнала СН-салицилового
альдегида в момент времени t1, принимаемый
за начальный, Аt – амплитуда этого сигнала в
момент времени t, ![]() .
.
Для устранения влияния возможного изменения условий записи спектра вместо Аt1 лучше использовать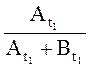 , а
вместо Аt –
, а
вместо Аt –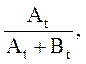 где
где ![]() – амплитуды сигнала СН-протона основания
Шиффа в моменты времени
– амплитуды сигнала СН-протона основания
Шиффа в моменты времени ![]() и
и ![]() соответственно.
соответственно.
Вариант 1
Провести определение kэфф при трех–четырех различных температурах 20, 30, 40 и 50 0С. [NН2Рh] = 1,0 М, [Salald] = 0,1 М. Поскольку при 20 0С реакция идет медленно, имеет смысл запустить реакцию при 20 0С в начале занятия, поместить раствор в ампулу ЯМР и записывать спектр через каждый час в промежутке между другими измерениями.
Определить энергию активации реакции.
Вариант 2
Провести определение kэфф при четырех–пяти различных концен-трациях анилина 0,7; 1,2; 1,7; 2,0; 2,5 M при 30 0С, [Salald] = 0,1 М.
Определить порядок реакции по анилину. Реакция при 0,7 и 1,2 М анилина идет достаточно медленно, поэтому, чтобы освоиться с системой, лучше начать с концентрации 1,7 M.
Задача К-7
ИЗУЧЕНИЕ КИНЕТИКИ РЕАКЦИИ
ЙОДИРОВАНИЯ АЦЕТОНА
СПЕКТРОФОТОМЕТРИЧЕСКИМ МЕТОДОМ
Реакция йодирования ацетона
CH3COCH3 + I2 ® CH2COCH2I + HI
идет с заметной скоростью, как в кислой, так и в щелочной средах. Механизм этой реакции в этих средах различен. В растворах сильных кислот в водной среде схема реакции может быть записана в виде следующей последовательности стадий:
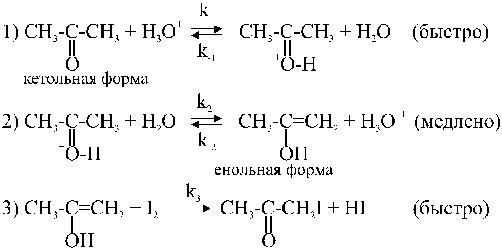
В первых двух стадиях кетон переходит в енол. Кислота ускоряет как прямую, так и обратную реакции кето-енольного перехода. В отсутствие йода в системе устанавливается равновесие между двумя формами. При введении в раствор йода происходит взаимодействие I2 с енольной формой (третья стадия), в результате чего енол выводится из реакции. Таким образом, третья стадия состоит в связывании енольной формы йодом. Третья стадия идет быстро и не влияет на общую скорость процесса.
Авторами работы [3] было доказано, что эффективная константа скорости kэфф не зависит от концентрации йода и не изменяется при замене йода на бром. Вместе с тем скорость реакции прямо пропорциональна концентрации ионов H3O+. Это отвечает механизму, в котором общая скорость реакции определяется процессом енолизации ацетона, причем стадия протонирования ацетона является быстрой и равновесной, а стадия образования енольной формы является медленной и лимитирующей. В этом случае скорость реакции равна
![]() (1)
(1)
Учитывая что, константа равновесия протонирования ацетона равна
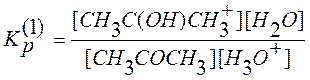 , (2)
, (2)
выражение для скорости реакции (1) нетрудно привести к виду
![]() . (3)
. (3)
В этом случае эффективная константа скорости равна
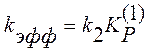 (4)
(4)
Кинетические исследования проводят спектрофотометрическим методом. Для измерений можно использовать длину волны от l = 350 нм (максимум в спектре поглощения) до l = 410 нм (склон пика поглощения).
К - 7.1. Определение порядков реакции по реагентам
и энергии активации реакции
Данная реакция является примером медленно идущей реакции, поэтому для нее хорошо применим метод расчета по начальной скорости. Хотя концентрация йода не входит в кинетическое уравнение, кинетику удобно исследовать именно по убыли йода, применяя спектрофотометрический метод. Обозначим начальные концентрации ацетона и ионов водорода соответственно CA и CH. Тогда скорость реакции с учетом уравнения запишется в виде
|
|
(5) |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.