3. Калий фосфорнокислый однозамещенный;
4. Натр едкий, раствор;
5. Калий иодистый;
6. Раствор глюкозооксидазы (хранится в холодильнике).
НЕОБХОДИМОЕ ОБОРУДОВАНИЕ:
1. Спектрофотометр SPECORD UV VIS или аналогичный;
2. рН-метр;
3. Автоматические микропипетки на 5 (10, 20) мкл;
4. Автоматическая микропипетка с переменным объемом на 200 мкл.
Экспериментальная часть
Измерение скоростей ферментативной реакции проводят непосредственно в кювете спектрофотометра. Для этого в кювете смешивают приготовленные заранее реагенты (КI-реактив, раствор глюкозы, буфер), термостатируют до нужной температуры. Реакцию начинают добавлением аликвоты фермента (5–10 мкл), немедленно интенсивно перемешивают и записывают кинетическую кривую. Регистрация длится 1–5 мин в зависимости от количества добавленного фермента.
Каждый эксперимент воспроизводят 2–4 раза.
Приготовление растворов
Приготовление 0,05 М калий-фосфатного буфера рН 6,0
· Провести калибровку рН-метра по стандартному раствору с рН 6,86 при 25 0С.
· 1,71 г калия фосфорнокислого однозамещенного растворить в дистиллированной воде в стакане объемом 200 мл. Довести рН полученного раствора до значения 6,0 на рН-метре с помощью раствора едкого натра. Перенести содержимое стакана в мерную колбу на 250 мл, довести до метки дистиллированной водой.
Приготовление KI-реактива
· KI-реактив должен быть свежеприготовленным.
· 0,83 г калия иодистого растворить в 8 мл буферного раствора рН 6,0, добавить 2 мл 9%-ного раствора молибдата натрия, перемешать. Использовать в течение одного занятия.
Приготовление 10%-ного раствора D-глюкозы
1 г D-глюкозы растворить в 10 мл буферного раствора, выдержать не менее 2 часов для протекания реакции мутаротации с образованием эквимолярной смеси a- и b-D-глюкозы.
Изучение кинетики реакции при различных концентрациях глюкозы в растворе
Запись кинетических кривых проводят на спектрофотометре при постоянной длине волны l = 350 нм.
В кварцевую кювету толщиной 1 см помещают 0,5 мл КI-реактива, затем добавляют 10%-ный раствор глюкозы и буферный раствор рН 6,0 в следующих пропорциях:
|
10% р-р глюкозы, мкл |
10 |
20 |
50 |
100 |
200 |
400 |
1000 |
|
буферный раствор, мл |
1,5 |
1,5 |
1,45 |
1,4 |
1,3 |
1,1 |
0,5 |
Термостатируют кювету при 25 С в течение 10–15 мин.
Автоматической микропипеткой вносят 5 (или 10) мкл раствора глюкозооксидазы, интенсивно перемешивают и записывают кинетическую кривую. Опыт воспроизводят 2–4 раза.
Обработка экспериментальных данных, расчет кинетических параметров
Из кинетических кривых определяют начальную скорость окисления глюкозы, равную скорости выделения перекиси водорода в ферментативной реакции. Концентрацию перекиси водорода в свою очередь определяют по реакции с KI-реактивом
Н2О2 + 3I– + 2Н+ ® 2Н2О + I3–,
в результате которой образуется I3–, имеющий максимум поглощения при 350 нм с коэффициентом экстинции e = 2,5´104 л/моль×см.
Строят график зависимости начальной скорости реакции Wо, выраженной в мкмолях выделившейся перекиси водорода в 1 мин на 1 мкл раствора фермента, от начальной концентрации субстрата в растворе S0, моль/л. Обработку экспериментальных данных проводят графически в обратных координатах Лайнувера–Берка 1/W0 – 1/S0 (уравнение 1), а также Корниш–Боуден W0 – W0/S0 (уравнение 2).
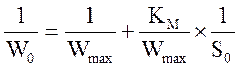 (уравнение 1),
(уравнение 1),
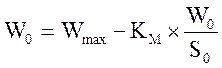 (уравнение 2).
(уравнение 2).
Из полученных графиков вычисляют константу Михаэлиса по глюкозе КМ и максимальную скорость реакции Wmax в данных условиях.
Задача Г-3
ИЗУЧЕНИЕ КИНЕТИКИ РЕАКЦИИ ОКИСЛЕНИЯ ОКСИДА АЗОТА КИСЛОРОДОМ МЕТОДОМ ОПТИЧЕСКОЙ СПЕКТРОСКОПИИ
Окисление оксида азота молекулярным кислородом до диоксида протекает как тримолекулярная реакция.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.