5. Какие еще виды влияния среды на скорость элементарной химической реакции вы знаете?
КИНЕТИКА РЕАКЦИЙ С УЧАСТИЕМ ФЕРМЕНТОВ
Ферменты как природные катализаторы многочисленных химических превращений, происходящих в живой клетке, обладают уникальными свойствами, прежде всего, высокой хемо-, регио-, стерео-специфичностью по отношению к субстрату S, продукту Р и типу реакции, а также высокой эффективностью катализа, при которой масштаб ускорения реакций в присутствии ферментов достигает 108–1012 раз по сравнению с гомогенными катализаторами химической природы. Именно стереоспецифичность биокатализа по отношению к субстрату (ферменты катализируют превращение либо D-, либо L-изомера), а также к образовавшемуся продукту, в котором содержание одного из энантиоизомеров (R- или S-) может достигать 99%, является главным отличием и несомненным преимуществом биокатализа перед химическим катализом.
Глюкозооксидаза (го, b-D-глюкоза: кислород 1-оксидоредуктаза, КФ 1.1.3.4) осуществляет реакцию окисления b-D-глюкозы кислородом воздуха при температурах, близких к комнатной:
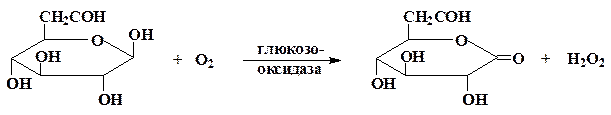
Молекула фермента глюкозооксидазы (Е) молекулярного веса 150 000 Дальтон имеет четвертичную структуру и состоит либо из 2, либо из 4 субъединиц в зависимости от источника его выделения (бактерии, плесень). Каждая субъединица содержит 1 молекулу прочно связанного кофермента – флавинаденин динуклеотида (ФАД+), непосредственно участвующего в окислительно-восстановительных превращениях субстратов – глюкозы и кислорода.
Ферментативная реакция протекает по “пинг-понг” механизму, т.е. стадийно с последовательным присоединением сначала первого субстрата (глюкозы), затем второго субстрата (кислорода), без образования тройного фермент-субстратного комплекса:
1 стадия – окисление глюкозы коферментом в реакции: глюкоза + ФАД+/ГО " глюконолактон + ФАД×Н2/ГО.
Через образование ковалентно-связанного аддукта ФАД+×××××глюкоза происходит перенос двух электронов (атомов водорода) между глюкозой и флавиновой группировкой (см на рис.):
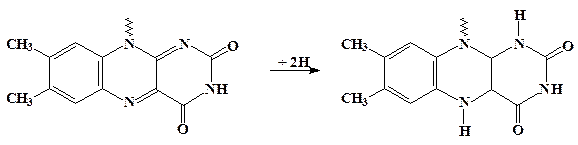
2 стадия – распад фермент-субстратного комплекса с освобождением продукта реакции (глюнолактона) и восстановленной формы фермента ФАД×Н2/ГО.
3 стадия – окисление восстановленной формы фермента кислородом воздуха в исходное окисленное состояние фермента ФАД+/ГО с освобождением второго продукта – перекиси водорода.
МЕХАНИЗМ ДЕЙСТВИЯ глюкозооксидазы можно изобразить на схеме:
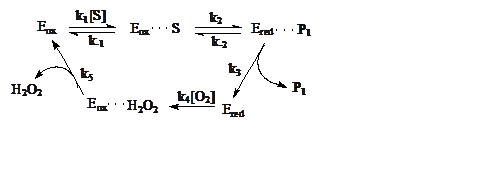
S – глюкоза, P1 – глюконолактон, Eox – окисленная форма фермента ФАД+/ГО, E red – восстановленная форма фермента ФАД×Н2/ГО.
Общее уравнение стационарной кинетики в упрощенном виде можно записать следующим образом:
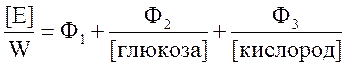 ,
,
где [E] – концентрация фермента, W – скорость ферментативной реакции, Ф1, Ф2, Ф3 – константы, значение которых определяется совокупностью констант скоростей реакций отдельных стадий.
Предложенные в практикуме лабораторные работы по ферментативному катализу предполагают исследование уникальных свойств ферментов и кинетики их действия на примере изучения реакции окисления глюкозы кислородом воздуха под действием глюкозооксидазы.
Задача К-31
ИЗУЧЕНИЕ СПЕЦИФИЧНОСТИ ДЕЙСТВИЯ ФЕРМЕНТА
ГЛЮКОЗООКСИДАЗЫ
Целью данной работы является изучение одного из уникальных свойств ферментативного катализа – специфичности фермента по отношению к субстрату. Благодаря этому свойству, ферменты широко используются в аналитической химии для селективного определения нужного соединения в многокомпонентных сред. Например, глюкозооксидаза применяется в клинических анализах для определения содержания глюкозы в крови (плазме, сыворотке) у больных сахарным диабетом.
Для определения специфичности фермента используют набор углеводов (глюкозу, маннозу, галактозу) и сравнивают скорости ферментативной реакции в присутствии этих субстратов.
НЕОБХОДИМЫЕ РЕАКТИВЫ:
1. Набор углеводов;
2. 9%-ный раствор молибдата натрия;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.