где [P] – концентрация образующегося продукта йодацетона.
Следует отметить, что в уравнении (5) использована
начальная концентрация ацетона СА вместо равновесной концентрации
(см. уравнение (3)) поэтому эффективная константа скорости (4) заменена на
опытную константу – kоп.
Более детальное рассмотрение процесса с учетом быстро устанавливающегося
равновесия в первой стадии приведено в задаче К-7.2. ![]()
Если начальные концентрации реагентов выбраны так, что
начальная концентрация йода СI
значительно меньше, чем начальные концентрации остальных реагентов, т.е.
выполняются условия: СA>>CI и СH>>CI, тогда ![]() и
и ![]() . При
этом выражения в скобках в уравнении (5) будут очень близки к единице в широком
диапазоне степеней превращения ацетона в йодацетон. В этом случае выражение (5)
можно переписать в виде
. При
этом выражения в скобках в уравнении (5) будут очень близки к единице в широком
диапазоне степеней превращения ацетона в йодацетон. В этом случае выражение (5)
можно переписать в виде
W = kоп×CA×CH. (6)
Отсюда
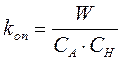 (7)
(7)
Поскольку в ходе реакции происходит расходование йода, то скорость реакции удобно измерять по изменению оптической плотности D раствора на длине волны поглощения йода:
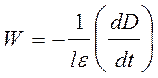 , (8)
, (8)
где e – экстинкция йода, l – толщина кюветы. Следовательно, выражение для опытной константы скорости (7) с учетом уравне- ния (8) можно переписать в виде:
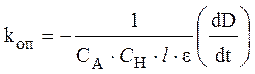 . (9)
. (9)
Таким
образом, для определения kоп нужно изучить зависимость D
от t в начальный период реакции и определить угловой коэффициент ![]() . Кроме того, нужно знать начальные
концентрации ацетона и кислоты и экстинкцию йода на выбранной длине волны.
. Кроме того, нужно знать начальные
концентрации ацетона и кислоты и экстинкцию йода на выбранной длине волны.
Эксперимент и расчеты
Реакцию изучают при строго определенной температуре, при фотометрировании используют длину волны l = 410 нм.
Приготовление растворов
Готовят два исходных раствора:
А – раствор йода с концентрацией 1,1×10–3 М.
B – раствор соляной кислоты концентрацией 1,00 М (этот раствор может быть приготовлен лаборантом).
Раствор йода готовят следующим образом: точно рассчитанную навеску йода растворяют в небольшом количестве (30 % от объема колбы) 10 %-го раствора KI, а затем доводят полученный раствор в колбе до метки водой.
Из раствора A готовят точным разбавлением водой пять рабочих растворов йода с концентрациями
0,5×10–4; 0,75×10–4; 1,0×10–4; 3,0×10–4; 5,0×10–4 М.
Измеряют оптическую плотность этих растворов на l = 410 нм в кювете l = 1 см. Проверяют закон Бугера–Ламберта–Бера. Из наклона прямой D от концентрации йода определяют экстинкцию йода на данной длине волны.
Проводят кинетические эксперименты, выбирая следующие концентрации исходных веществ (в моль/л):
|
Номер опыта |
Концентрация ацетона, M |
Концентрация HCl, M |
Концентрация йода, M |
|
1 |
0.1 |
0.1 |
1,1×10–4 |
|
2 |
0.05 |
0.1 |
1,1×10–4 |
|
3 |
0.1 |
0.05 |
1,1×10–4 |
|
4 |
0.1 |
0.05 |
0,7×10–4 |
|
5 |
0.15 |
0.1 |
1,1×10–4 |
|
6 |
0.1 |
0.15 |
1,1×10–4 |
Кинетический опыт лучше проводить в такой последовательности:
- в мерную колбу на 100 мл добавляют пипеткой рассчитанные количества растворов A и B (например, по 10 мл),
- заполняют водой большую часть колбы, не доводя ее уровень до метки,
- приливают точно рассчитанное количество чистого ацетона (плотность ацетона r при 20 0С равна 0,7908 г/см3, М.в. = 58 г/моль), быстро перемешивают раствор, включают секундомер,
- доливают колбу водой до метки, снова перемешивают раствор,
- переливают раствор в кювету и начинают кинетические измерения оптической плотности в зависимости от времени на длине волны 410 нм.
Реакцию ведут до обесцвечивания раствора: D < 0.1.
После проведения эксперимента строят графики
зависимости D от t и определяют величину ![]() .
Используя уравнение (9), рассчитывают во всех четырех опытах значения kоп.
Сводят данные в таблицу и делают выводы о зависимости скорости реакции от
концентрации ацетона, кислоты и йода, а также о корректности выбранного
механизма. Определяют порядки реакции по ацетону, кислоте и йоду.
.
Используя уравнение (9), рассчитывают во всех четырех опытах значения kоп.
Сводят данные в таблицу и делают выводы о зависимости скорости реакции от
концентрации ацетона, кислоты и йода, а также о корректности выбранного
механизма. Определяют порядки реакции по ацетону, кислоте и йоду.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.