3. Калий фосфорнокислый однозамещенный;
4. Натр едкий, раствор;
5. Калий иодистый;
6. Раствор глюкозооксидазы (хранится в холодильнике).
НЕОБХОДИМОЕ ОБОРУДОВАНИЕ:
1. Спектрофотометр SPECORD UV VIS или аналогичный;
2. рН-метр;
3. Автоматические микропипетки на 5 (10, 20) мкл.
Экспериментальная часть
Измерение скоростей ферментативной реакции проводят непосредственно в кювете спектрофотометра. Для этого в кювете смешивают приготовленные заранее реагенты (КI – реактив, раствор углевода, буфер), термостатируют до нужной температуры. Реакцию начинают добавлением аликвоты фермента, немедленно интенсивно перемешивают и записывают кинетическую кривую. Регистрация длится 1–5 мин в зависимости от количества добавленного фермента.
Каждый эксперимент воспроизводят 2–4 раза.
Приготовление растворов
Приготовление 0,05 М калий-фосфатного буфера рН 6,0
· Провести калибровку рН-метра по стандартному раствору с рН = 6,86 при 25 0С.
· 1,71 г калия фосфорнокислого однозамещенного растворить в диcтилированной воде в стакане объемом 200 мл. Довести рН полученного раствора до значения 6,0 на рН-метре с помощью раствора едкого натра. Перенести содержимое стакана в мерную колбу на 250 мл, довести до метки дистиллированной водой.
Приготовление КI - реактива
· КI - реактив должен быть свежеприготовленным.
· 0.83 г калия йодистого растворить в 8 мл буферного раствора рН 6,0, добавить 2 мл 9%-ного раствора молибдата натрия, перемешать. Использовать в течение одного занятия.
Приготовление 10%-ных растворов углеводов.
· 0.5 г сахара растворить в 5 мл буферного раствора рН 6,0.
Изучение кинетики действия фермента в присутствии
различных субстратов
Запись кинетических кривых проводят на спектрофотометре SPECORD UV VIS на длине волны l = 350 нм (2860см-1) и используя временную развертку 2,2 мин или 4,4 мин.
В кварцевую кювету длиной 1 см помещают:
· 0,4 мл 10%-ного раствора сахара,
· 0,5 мл КI - реактива,
· 1,1 мл буферного раствора рН 6,0.
Общий объем раствора в кювете 2 мл, конечная концентрация сахара в кювете 2%.
Термостатируют кювету с раствором при 25 0С в течение 10–15 мин. Автоматической микропипеткой вносят 5 или 10 мкл раствора фермента, интенсивно перемешивают и записывают кинетическую кривую. Опыт воспроизводят 2–4 раза.
Определение количества выделившейся в результате ферментативной реакции перекиси водорода проводят по реакции с КI-реактивом (Н2О2 + 3I- + 2Н+ ® 2Н2О + I3-). В результате реакции образуется I3-, который имеет коэффициент экстинкции e = 2,5´104 л/моль×см в максимуме линии поглощения при 350 нм.
Результаты записывают в таблицу:
|
Субстрат |
Начальная скорость реакции, (мкмоль выделившейся перекиси водорода в 1 мин на 1 мкл раствора глюкозооксидазы) |
Относительная активность, % |
|
b-D-глюкоза |
100 |
|
На основании полученных данных делают вывод о специфичности действия глюкозооксидазы.
Задача К-32
ОПРЕДЕЛЕНИЕ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ ФЕРМЕНТАТИВНОГО ОКИСЛЕНИЯ ГЛЮКОЗЫ КИСЛОРОДОМ ПОД ДЕЙСТВИЕМ ГЛЮКОЗООКСИДАЗЫ
Целью данной работы является определение кинетических параметров реакции окисления глюкозы кислородом, осуществляемой ферментом глюкозооксидазой: константы Михаэлиса КМ и максимальной скорости реакции Wmax.
В выбранных условиях при постоянной начальной концентрации кислорода в растворе ферментативная реакция протекает по кинетическому закону Михаэлиса–Ментен:
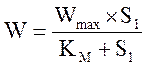 ,
,
где W – скорость ферментативной реакции, моль/л×с;
Wmax – максимальная скорость реакции, моль/л×с;
KM – константа Михаэлиса , моль/л;
S1 – концентрация субстрата (глюкозы), моль/л.
НЕОБХОДИМЫЕ РЕАКТИВЫ:
1. b-D-глюкоза;
2. 9%-ный раствор молибдата натрия;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.