Повторить всю процедуру ещё два раза при начальном давлении NO примерно 70 и 130 мм. Полученные кинетические кривые сохранить в файлы, а данные о D¥ использовать для определения коэффициента экстинкции NO2.
Повторить процедуру при начальном давлении NO 100 мм, но используя для его окисления не воздух, а чистый кислород. Выполнить этот опыт с помощью преподавателя или лаборанта.
Определение порядка реакции и константы скорости
Перед началом вычислений нужно перенести данные из спектрофотометра в компьютер. Эта процедура описана в инструкции по работе с прибором, которая имеется на рабочем месте. Для построения графиков рекомендуется программа “Origin”. В программе имеются возможности предварительной обработки данных. Краткое описание программы есть на рабочем месте, более подробное – в методическом пособии [1]. Если для обработки данных вы используете “Excel”, то для построения графиков рекомендуется получившуюся таблицу (книгу) перенести в “Origin”.
Порядок реакции по NO можно определить методом анаморфоз.
Первоначально нужно перестроить кинетическую кривую накопления NO2 в кинетическую кривую расходования NO, то есть построить зависимость концентрации NO в моль/л от времени. Нужно учесть два обстоятельства. Во-первых, начальное значение оптической плотности, пока шла регистрация, но реакцию мы ещё не запустили, возможно, не равно нулю и его нужно вычесть. Во-вторых, как вы видите, начальный участок кинетической кривой записан некорректно (открывали–закрывали кюветное отделение и пр.), его нужно удалить, а «начальный момент времени» следует определить, экстраполируя кинетическую кривую к нулевой концентрации NO2.
Чтобы подтвердить предположение, что реакция имеет второй порядок по оксиду азота нужно построить анаморфозу:
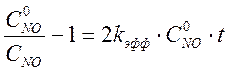
или
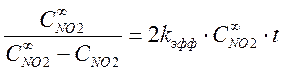 ,
,
где kэфф = k3×Cкисл., k3 – истинная константа скорости третьего порядка, а Cкисл – концентрация кислорода в воздухе или чистом кислороде.
Для сравнения постройте также анаморфозу первого порядка
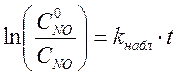 .
.
Сделайте вывод о порядке реакции по NO.
Порядок реакции можно определить другим
способом, если построить зависимость ln(W) от ln(CNO), где W – скорость реакции при концентрации NO
равной CNO. Скорость реакции равна 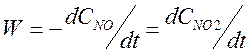 . В программе “Origin” можно вычислить
производную, выбирая последовательно Analysis, Calculus, Differentiate или Diff/Smooth, но в результате будет построен график W от t, а
нам нужно иное. Однако, результаты дифференцирования отображаются в новой
колонке, которая появляется в окне “Worksheet”. Поэтому следует построить
новый график, вычислив предварительно логарифмы от полученной производной и
текущий концентрации NO.
. В программе “Origin” можно вычислить
производную, выбирая последовательно Analysis, Calculus, Differentiate или Diff/Smooth, но в результате будет построен график W от t, а
нам нужно иное. Однако, результаты дифференцирования отображаются в новой
колонке, которая появляется в окне “Worksheet”. Поэтому следует построить
новый график, вычислив предварительно логарифмы от полученной производной и
текущий концентрации NO.
Чтобы построить график ln(W) от ln(CNO), щелкните по кнопке «Plot» и выберите «Scatter». Сопоставьте соответствующим колонкам символы «X» и «Y», для этого щелкните один раз по имени колонки, затем по кнопке «« Х» или ««Y», после этого нажмите «OK». Чтобы провести прямую методом МНК нажмите «Analysis» и «Fit linear». Измените надписи по осям, щелкните по ним правой кнопкой.
После нахождения порядка реакции, найдите из анаморфозы константу скорости kэфф. Поскольку kэфф = k3×Cкисл и концентрация кислорода в воздухе известна (~ 21%) не составляет труда найти истинную константу скорости третьего порядка k3.
Теоретический расчёт константы скорости k3
Рассчитайте константу скорости реакции 2 NO + O2 = 2NO2 по теории активированного комплекса, считая, что E0 = 0, и предпо-лагая структуру активированного комплекса максимально облегчающую расчёт, например, циклическую или линейную.
Литература
1. Шаронов В. Е. Компьютер для химика. Учебно-методич. Пособие. Новосибирск, НГУ. 2006.
[1] Для справки. Плотность дибутилфталата равна плотности воды.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.