Для определения энергии активации Eакт реакции йодирования ацетона и предэкспоненциального множителя kо проводят опыты при одной или двух более высоких температурах в термостатированных кюветах. По найденным значениям kоп при разных температурах рассчитывают по уравнению Аррениуса значения Eакт и kо.
K - 7.2. Нахождение истинной константы скорости реакции йодирования ацетона и константы равновесия протонирования ацетона
Для определения истинной константы скорости k2 и константы равновесия протонирования ацетона выражение для скорости реакции (1) можно записать иначе:
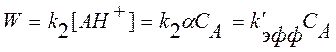 , (10)
, (10)
где
[AH+] -
равновесная концентрация протонированной формы ацетона,
![]() - эффективная константа скорости, a - степень протонирования ацетона, равная
- эффективная константа скорости, a - степень протонирования ацетона, равная
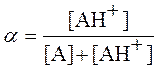 , (11)
, (11)
где [A] - равновесная концентрация не протонированной формы ацетона. Используя уравнения (11) и (2), с учетом того, что в начальный момент времени сумма [A] + [AH+] равна общей концентрации ацетона СА и считая концентрацию воды постоянной, легко показать, что
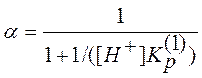 . (12)
. (12)
Эффективная константа скорости с учетом (10) и (12) будет равна
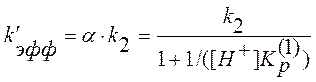 . (13)
. (13)
Эффективную константу скорости k’эфф, легко найти по графику зависимости оптической
плотности раствора D от времени t, найдя производную ![]() на начальном участке графика и используя
уравнение (10)
на начальном участке графика и используя
уравнение (10)
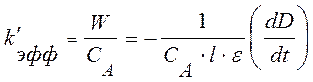 (14)
(14)
Уравнение (13) можно преобразовать к виду, который удобно использовать в качестве линейной анаморфозы для обработки экспериментальных данных:
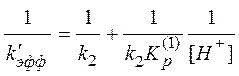 (15)
(15)
Таким
образом, найдя k’эфф
из экспериментальных данных для разных концентраций HCl, можно построить
зависимость (15) и из параметров прямой определить k2 и
константу протонирования ацетона ![]() .
.
Эксперимент и расчеты
Реакцию изучают при строго определенной температуре и на длине волны l = 350 нм.
1. Готовят растворы A и B (как в задаче К - 7.1).
2. Для определения экстинкции на данной длине волны (аналогично задаче К - 7.1) готовят растворы йода с концентрацией
1,0×10–4; 2,5×10–4; 5,0×10–4; 7,0×10–4; 1,0×10–3 М.
3. Кинетические эксперименты проводят используя растворы с концентрацией ацетона 0,1 моль/л, начальной концентрацией йода 7,0×10–4 моль/л и со следующими концентрациями HCl: 0,05; 0,07; 0,09; 0,10; 0,12; 0,13; 0,14 моль/л. Наиболее удобный порядок приготовления рабочих растворов описан в задаче К - 7.1.
4. Строят зависимости D = D(t). Определяют величину k’эфф, используя (9) и (15). Используя уравнение (16),
находят значения k2 и константу протонирования ацетона ![]() при
данной температуре.
при
данной температуре.
Контрольный вопрос
Рассмотрите реакцию йодирования ацетона в водном растворе слабой кислоты (HA). К какому типу кислотно-основного катализа относится данная реакция? Рассмотрите реакцию, в которой первые две стадии предложенного механизма являются быстрыми и равновесными, а лимитирующей стадией является третья стадия образования продукта.
Литература
1. Эмануэль Н.М., Кнорре Д.Г. Курс химической кинетики. 4-е изд. М.: Высш. школа, 1984, С. 333-345.
2. Замараев К.И. Химическая кинетика. Курс лекций. Новосибирск, 1994. Часть 3, С. 28-38.
3. Рудаков Е.С. Практикум по физической химии и кинетики. Кинетика реакций в растворах (учебно-методическое пособие для студентов химиков НГУ), Новосибирск, 1967, С 30.
Задача К-8
![]()
ГОМОГЕННЫЙ КАТАЛИЗ
ДИСПРОПОРЦИОНИРОВАНИЯ Н2О2 АКВА-ИОНАМИ Fе2+.
ВОЛЮМОМЕТРИЧЕСКИЙ МЕТОД
Легкость разложения (диспропорционирования) перекиси водорода на воду и молекулярный кислород (см. уравнение (1)) является характерным свойством этого соединения.
![]() (1)
(1)
Реакция (1) ускоряется под действием излучений, например, ультрафиолетового света (вследствие чего растворы H2O2 необходимо хранить в затемненной или непрозрачной посуде), а также в присутствии катализаторов, как гетерогенных (стекло, уголь, многие металлы, их соли и окислы) так и гомогенных (например, растворимые соединения переходных металлов) [1].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.