Білки мітохондрій і хлоропластів, які кодуються ядерними ДНК, мають на N-кінці надлишкові амінокислотні послідовності, які вибірково направляють поліпептидні ланцюги в певні компартменти органел, після чого відщеплюються в результаті протеолізу за участю специфічних эндопептидаз. Надлишкові послідовності попередників білків мітохондрій істотно розрізняються за кількістю амінокислотних залишків; їх може бути від 22 до 80. Короткі послідовності характеризуються високим (20-25%) змістом позитивно заряджених амінокислотних залишків, рівномірно розташованих по поліпептидному ланцюзі. Довгі послідовності включають додатково ділянку, що складається з гідрофобних амінокислот, що «якорить» попередник у ліпідному бішарі мітохондріальних мембран.
Відомі попередники для ряду гормонів (наприклад, для гастрину, глюкагона й інсуліну), які переходять в активну форму за допомогою розщеплення поліпептидного ланцюга в ділянках, що містять два послідовно розташованих залишки основних амінокислот (аргінін і лізин). Розщеплення здійснюється за участю специфічної ендопептидази, що діє в ансамблі із другим ферментом, що має карбоксипептидазну активність. Останній видаляє залишки кінцевих основних амінокислот, завершуючи перетворення пептиду в активний гормон. До білків, що піддаються протеолітичній активації, відносяться також протеінази (пепсин, трипсин, хімотрипсин), альбуміни, проколагену, білки системи згортання крові й інші. У деяких випадках неактивні форми ферментів (зімогени) необхідні для тимчасової «консервації» ферментів. Так, зімогени трипсину й хімотрипсину (відповідно трипсиноген і хімотрипсиноген) синтезуються в підшлунковій залозі, секретируются в тонкий кишечник і тільки там під дією специфічних ферментів перетворюється в активну форму.
Широке коло білків (гістони, міозин, актин, рибо-сомальні білки й інші) метилюються посттрансляційно за залишками лізину, аргініну й гістидину (N-метилювання), а також за залишками глутаміновойї і аспарагінової кислот (О- метилювання). У якості метилюючого агента звичайно виступає S-аденозилметіонін.
У деяких еукаріотичних клітках більше половини розчинних білків ацетильовані за N-кінцем. Цей процес може здійснюватися контрансляционно й посттранcляційно:
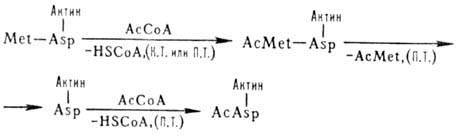
HSCo – кофермент А;
Ассоа – ацетилкофермент A;
Met – метіонін;
Asp – аспарагінова кислота
Для пептидів, що містять від 3 до 64 амінокислотних залишків і які серкретуються у різних органах (гастрин, секретин, холецистокінін і інші), виявлене пост трансляційне амідування залишку С-кінцевої амінокислоти (за винятком кінцевих залишків аргініну й аспарагіну).
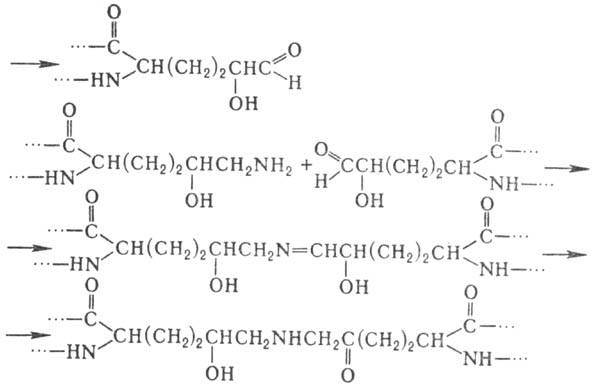
Деякі типи модифікацій характерні для окремих білків або невеликих груп білків. Зокрема , у колагені й декількох інших білках з подібними амінокислотними послідовностями виявлені 4- і 3-гідроксипролін, а також 5-гідроксилізин. Гидроксилювання залишків проліну й лізину протікає котрансляційно і має важливе значення для формування унікальної структури колагену. Гиіроксилізин бере участь в утворенні ковалентних зшивок між поліпептидними ланцюгами колагену за схемою:
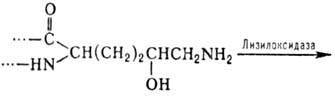
Ядерні білки (гістони, негістонові білки) піддаються аденозиндифосфатрибозилюванню та поліаденозиндифосфатрибозилюванню, у ході якого аденозиндифосфатрибозильні залишки переносяться від коферменту нікотинамідаденіндинуклеотида (НАД) до акцепторних білків:

Ці дві реакції різні в багатьох аспектах. Зокрема , поліаденозиндифосфатрибозилювання протікає в присутності ДНК. Більшість аденозиндифосфатрибозильних груп приєднується до білку за допомогою ефірного зв’язку, утвореного групою ОН у положенні 5’ залишку рибози й групою СООН С-кінцевої амінокислоти або глутамінової кислоти, що перебуває усередині поліпептидного ланцюга.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.