Позаклітинні білки, а також численні білки цитоплазматичної мембрани й різних внутрішньоклітинних компартментів (відособлених ділянок клітки) піддаються глікозилюванню, у результаті якого утворяться глікопротеїни. Найбільше складно організовані маннозовмістні ланцюги, приєднані до поліпептидів N-глікозидним зв’язком. Початкова стадія формування таких ланцюгів протікає кoтранcляційно за схемою:
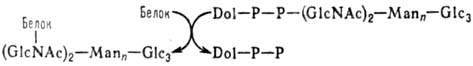
Dol – доліхол (поліпренол);
Dol-Р-Р – доліхолпірофосфат;
Glc – глюкоза;
GlсNас – N-ацетил-D-глюкозамін;
Маn – маноза
Останні стадії здійснюються посттрансляційно за участю декількох ферментів, локалізованих у різних субклітинних компартментах. Так, для G-білка вірусу везикулярного стоматиту, глікозидні ланцюги якого побудовані з 15 вуглеводних залишків, установлена така послідовність подій. Спочатку в ендоплазматичному ретикулумі відбувається у дві стадії відділення термінальних залишків глюкози за участю двох різних глюкозидаз. Потім маннозидази (І й ІІ) видаляють 6 залишків маннози, а N-ацетил-D-глюкозамінтрансфераза здійснює приєднання трьох залишків N-ацетил-D-глюкозаміна до залишків маннози глікопротеїну. Нарешті, у комплексі Гольджі із цими залишками зв’язуються за участю відповідних трансфераз залишки фруктози, галактози й сіалової кислоти. Моносахаридні залишки можуть піддаватися фосфорилюванню, сульфіруванню й іншим модифікаціям.
Гликозилырованню білків передує протеолітичний процесинг – відділення від N-кінця поліпептидного ланцюга «сигнальної» послідовності амінокислот. В еукариотичних клітках (клітки всіх організмів, за винятком бактерій і синє-зелених водоростей) цей процес здійснюється контрансляційно, у прокаріотичних клітках (клітки бактерій і синьо-зелених водоростей) він може протікати посттрансляційно. Найпоширеніші сигнальні послідовності включають 23 амінокислотних залишку. Характерні риси цих послідовностей – наявність на С-кінці короткої позитивно зарядженої ділянки, за якою йде гідрофобна ділянка, що містить від 7 до 14 амінокислотних залишків. Сигнальні послідовності завершуються консервативним по довжині (5 – 7 залишків) гідрофільною ділянкою, на кінці якої найчастіше знаходяться залишки аланіну, гліцину, серину, треоніну, цистeїну або глутаміну.
Майже всі функціональні класи позаклітинних білків (ферменти, гормони, імуноглобуліни й інші) містять дисульфидні зв’язки. Вони утворяться із груп SH цистеїну в ході багатостадійного процесу за участю ферменту дисульфідізомерази. На його ранніх стадіях з’являється значна кількість «неправильних» неправильних містків, які ліквідуються в результаті тіолдисульфідного обміну, у якому, очевидно, бере участь цистамін (H2NCH2CH2S)2. Припускають, що такий «перебір» зв’язків відбувається доти, поки не виникає найбільш стабільна третинна структура, у якій дисульфідні містки «поховані» і внаслідок цього недоступні реагентам.
До найпоширеніших модифікацій внутрішньоклітинних білків ставляться фосфорилювання і дефосфорилювання по групі ОН залишків серина, тірозину й треоніну, які здійснюються за участю ферментів протеінкіназ і фосфатаз за схемою:
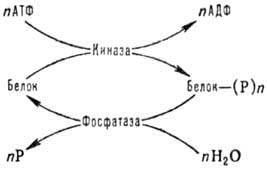
АТФ – аденозинтрифосфат;
АДФ – аденозиндифосфат;
Р – фосфорна кислота або її залишок.
Фосфорилювання супроводжується активацією або інактивацією ферментів, наприклад гликозилтрансфераз, а також зміною фізико-хімічних властивостей неферментативних білків. Оборотне фосфолювання білків контролює, наприклад, такі важливі процеси, як транскрипція й трансляція, метаболізм ліпідів, глюконеогенез, м’язове скорочення.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.