Рассмотрим теперь, в чем заключается механизм каталитического действия. Первое истолкование катализа как процесса образования и разложения нестабильных соединений на поверхности дал еще в конце 19 века Сабатье (1897). Однако общей теории, объясняющей все аспекты катализа и позволяющей предсказать тип катализатора для новой реакции, не существует и в настоящее время.
Упрощенно природу активной поверхности можно представить в виде двух моделей: 1) активна вся поверхность (Лэнгмюр 1922, Боресков 1957) и 2) катализ протекает на активных центрах поверхности (Тэйлор 1925). Согласно Тэйлору, такие центры включают различные кристаллические структуры и/или дефектные участки на поверхности. Таким образом, основное различие между указанными двумя концепциями катализа сводится к оценке роли коллективных или локальных взаимодействий в катализе.
Представления об активных центрах в настоящее время получили общее признание и хорошо подтверждаются экспериментальными данными об отравлении катализатора микропримесями, так называемых, каталитических ядов. Так, например, при катализе на металлах и твердых кислотах отравление катализатора наступает при наличии примесей сернистых соединений и азотистых оснований, соответствующих нескольким процентам от всех атомов на поверхности или 3-5 мкмоль/м2 (катализатора).
Эти представления были детально проработаны в рамках мультиплетной теории Баландина (1929). В теории каталитического действия Баландина был проведен совместный анализ геометрического и энергетического соответствия между активными центрами и фрагментами реагирующих молекул. Мультиплетная теория была подтверждена множеством экспериментов для различных реакций на катализаторах разных типов, выполненных как в лаб. Баландина, так и в других центрах (работы Ридиила, Бека и др.). Таким образом, в рамках мультиплетной теории активные центры рассматриваются как организованная группа частиц на поверхности, соответствующая молекулам реагентов, как по размеру, так и по энергии разрываемых связей.
Рассмотрим геометрический аспект теории. Было установлено, что для реакции дегидроциклизации парафинов с образованием ароматических углеводородов активные центры представляют собой секстеты, т.е. 6 атомов металлов VIII группы, расположенных как в правильном шестиугольнике. Поэтому в монокристалле эта реакция протекает только на грани [111], на которой имеются такие конфигурации, а на грани [110] не идет.
Наиболее распространены активные центры типа дублетов, на которых протекают реакции типа элиминирования и присоединения, например, превращения спиртов на оксидах металлов. В молекуле спирта длина С-С связи 1,54А больше длины связи С-ОН, 1,43А, поэтому с увеличением параметра решетки оксида МО до 1,6-1,7А преимущественно протекает процесс дегидрирования, а уменьшение параметра решетки способствует дегидратации.
Кроме геометрического соответствия, также необходимо энергетическое, которое рассмотрим на примере реакции АВ + СD àAC + BD, протекающей через активированный комплекс, типа приведенного ниже:
●
А ----- С
![]()
![]() ● ●
(Z) где Z - активные
центры
● ●
(Z) где Z - активные
центры
B ------ D
●
Используя закон Гесса, можно получить выражения для энергии образования активированного комплекса из исходных веществ ε1 и продуктов ε2 реакции
Кобозев (1946) определяет катализ как способ реализации элементарных актов без образования свободных валентностей. Запрет на образование свободных валентностей в ходе элементарного акта резко снижает эндотермический эффект реакции, и в результате значительно снижается энергия активации. В настоящее время нет сомнений, что катализатор взаимодействует с реагирующими молекулами с образованием интермедиатов, которые разлагаются с выделением продуктов реакции и исходного катализатора.
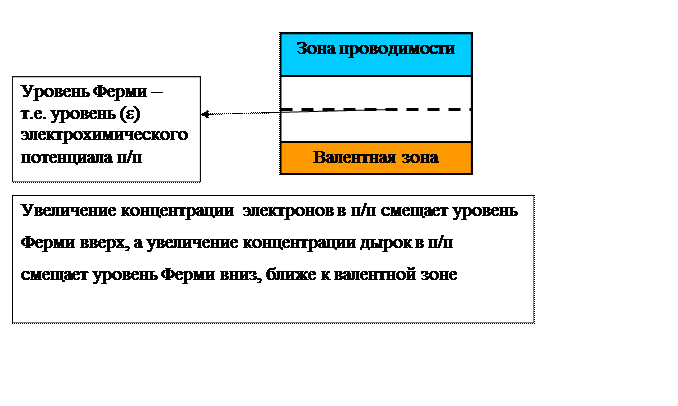
В соответствии с теорией Ф.Ф.
Волькенштейна, рассмотрим связь каталитической активности с электронными
свойствами твердого катализатора – полупроводника. Как известно, в полупроводниках
имеются 3 зоны: валентная, зона проводимости и разделяющая их запрещенная зона.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.