Контакт с ипритом не сопровождается неприятными ощущениями (немой контакт), вследствие паралитического действия на чувствительные рецепторы. Поражение развивается медленно, после скрытого периода, продолжительность которого от часа до нескольких суток. Иприт поражает все органы и ткани, с которыми вступает в контакт, местное поражение характеризуется симптомами воспаления. Помимо местного, всегда проявляется общетоксическое действие. Оно характеризуется угнетением ЦНС, кроветворения, нарушением кровообращения, пищеварения, всех видов обмена веществ, терморегуляции. Подавляются иммунные свойства организма и наблюдается наклонность к присоединению вторичной инфекции.
У ипритов выражено кумулятивное действие. В экспериментах на животных и в наблюдениях за отравленными людьми установлено сенсибилизирующее действие ядов.
В отличие от иприта, люизит является ОВ быстрого действия, скрытый период практически отсутствует. В парообразном состоянии уже в концентрации 0,002 г/м3 люизит вызывает резкое раздражение глаз (жжение, боль, слезотечение).
Минимальные пузыреобразующие дозы при попадании ОВ на кожу составляют:
для иприта 0,1 мг/см2
для азотистого иприта 0,3 мг/см2
для люизита 0,2 мг/см2
Средне смертельная доза LD50 при поступлении через кожные покровы составляет 70 мг/кг для иприта и 20 мг/кг для люизита.
При ингаляционном воздействии средне-смертельные концентрации составляют:
для иприта — 1,5 мгхмин/л для люизита — 1,3 мгхмин/л
При пероральном поступлении LD50 составляет 1–2 мг на кг массы тела.
Механизм токсического действия ипритов и патогенеза ипритных поражений очень сложен и до настоящего времени изучен не достаточно. Возможно, в этом кроется одна из причин неудачи всех попыток создания антидота.
Иприт является ферментным ядом, нарушающим процесс энергоснабжения клеток и всего организма.
Основным источником энергии, аккумулируемой в АТФ является глюкоза. В клетках глюкоза с помощью ферментных систем сначала подвергается ферментному расщеплению до двух молекул молочной кислоты — СН3СН(ОН)СООН. Молочная кислота подвергается дальнейшему кислородному расщеплению в последовательных окислительно-восстановительных реакциях до углекислого газа и водорода, который, в свою очередь окисляется кислородом до воздуха и воды. Энергия, высвобождаемая при этом, расходуется на регенерацию АТФ из АДФ.
Превращение глюкозы в молочную кислоту требует участия ряда ферментов. Свободная глюкоза предварительно фосфорилируется молекулой АТФ в присутствии гексокиназы — фермента, который переносит остаток фосфорной кислоты с молекулы АТФ на углевод с образованием глюкозо-6-фосфата:
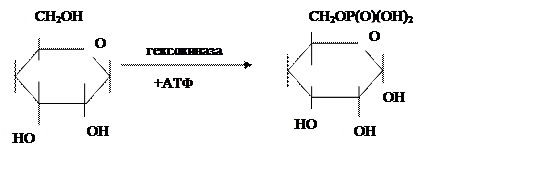 |
Гексокиназа представляет собой сложный белок, в котором полипептид через остаток фосфорной кислоты и пятичленный сахар (рибозу) соединен с пуриновым основанием, выполняющим функции простетической группы:
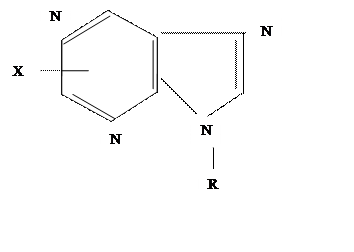 |
R — рибоза, к которой присоединен, через остаток фосфорной кислоты, протеиновый фрагмент гексокиназы с М около 96 тыс.
Х — амино или оксигруппа
Предполагается, что иприт алкилирует гексокиназу по атому азота пуринового основания:
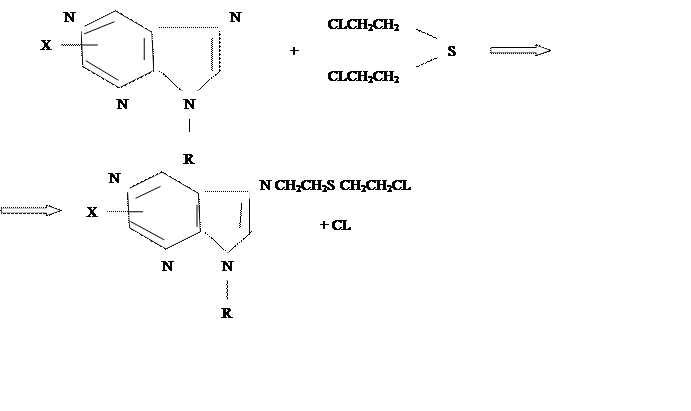 |
В слабощелочной среде происходит перестройка продукта реакции и потеря ферментом пуринового основания.
В итоге гексокиназа теряет активность, что вызывает нарушение процессов потребления и переноса энергии в клетках.
Иприт обладает способностью алкилировать также пуриновые основания, входящие в состав ДНК и РНК. Наибольшей чувствительностью к иприту отличается гуанин.
Согласно существующим представлениям, ДНК содержит две полипептидных цепи, стабильность пространственной конфигурации которых поддерживается водородными связями между противоположными основаниями: против аденина одной цепи всегда находится тимин другой цепи, против гуанина — цитозин.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.