Обнинский институт атомной энергетики.
Кафедра общей и специальной физики.
.
Оптические спектры атомов водорода и ртути
Составил: студент группы
ВТ1-98
Стешов В.Н.
Проверил: Карманов Ф.И.
ОИАТЭ 2000.
Оптические спектры атомов водорода и ртути Цель работы
1. Изучить закономерности в спектрах водорода и ртути.
2. Определить расстояние между энергетическими уровнями тонкой структуры атомов водорода и ртути.
Введение Атом водорода и водородоподобные атомы
Состояние электронов в атомах описывается волновой функцией удовлетворяющей уравнению Шредингера. Для атома водорода имеющего один электрон, и для водородоподобных атомов, состоящих из ядра с зарядом Ze и одного электрона, это уравнение имеет вид
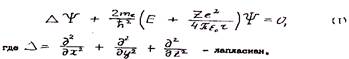
Е - полная энергия электрона в атоме; U=-Ze2/4πε0 - потенциальная энергия электрона (для атома водорода Z=1).
Квадрат модуля пси-функции определяет плотность вероятности
(вероятность, отнесенную к единице объема) нахождения частицы в данном месте пространства. Уравнение (I) имеет решения, удовлетворявшие требованиям однозначности, конечности и непрерывности волновой функции Ψ при дискретном наборе значений энергии Е. Эти значения называются собственными. Им соответствуют собственные функции Ψ зависящие от трех целочисленных параметров: n , l и me.
В квантовой механике ориентация вектора момента импульса не определена. Можно говорить лишь об его величине Me величине его проекции Mez на направление внешнего магнитного поля. При этом две другие проекции на перпендикулярные к направлению поля оси координат остаются неопределенными.
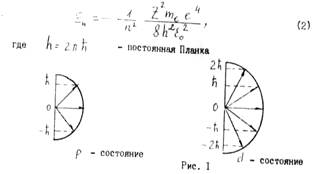
Вектор Мe подчиняется законам пространственного квантования, т.е. возможны лишь такие его ориентации в пространстве, при которых проекция Мez принимает значения, кратные постоянной Планка,
Пространственное квантование векторов Ме для электронов в состояниях с l = I и l = 2 приведено на рис. I.
Энергия электрона определяется одним квантовым числом n
Уровень внергии E1 соответствующий значению n=1 называ ется основным. Все остальные уровни En>E1 – возбужденные. При одном и том же значении энергии Еn , злектпон может иметь n различных значений момента импульса; которые могут проектироваться на направление внешнего поля 2l+1 способом.Таким образом состояний электрона, соответствующих уровню энергии Еn. Равно :
![]()
т.е. каждый уровень энергии имеет вырождение кратности n2 Различные состояния электрона принято обозначать символами каждый из которых содержит численный коэффициент, равный главному квантовому числу и буквенное обозначение орбитального квантов числа которое приведено в табл. 2.
|
Значение орбитального квантового числа l |
0 |
1 |
2 |
3 |
4 |
5 |
|
Обозначение состояния ЭЛ8кТЕ5аа,— |
s |
p |
d |
f |
g |
h |
Например, состояние, для которого n=1 и l=0, обозначается символом 1s при n=2 имеем состояния 2s и 2p при n = 3 - состояния 3s 3p и 3d.
Изучение и поглощение света атомами при переходе электронов c одного энергоуровня на другой в первые было объяснено с помощью постулатов Бора:
1. В атоме существует набор стационарных состояний, находясь в которых атом не излучает электромагнитных волн, хотя электроны движутся по стационарным орбитам с ускорением.
2. В стационарном состоянии атома, электрон имеет квантованные значения момента импульса.
3. При переходе атома из одного стационарного состояния Еn в другое En’ . Испускается или поглощается один фотон, энергия которого hν равна разности энергий этих состояний
![]()
В квантовой механике существуют правила отбора, которые ограничивают число возможных переходов электронов с одного уровня на другой. Согласно этим правилам возможны только такие переходы, для которых выполняются следующие условия для квантовых чисел l и me
![]()
Каждому переходу соответствует определенная линия в спектре излучения или поглощения. Длины волн излучения спектра водорода можно описать, объединяя формулы (2) и (4) и учитывая, что и Z=1
![]()
![]()
![]()
связанная с энергией как R’=En / hc Формула (6) носит название обобщенной формулы Бальмера. При каждом фиксированном n величина n' может принимать значения от ( n+ I) до ∞ . Группа линий, соответствующих данному n,, называется серией. Для спектров поглощения серия определяется переходами электронов с уровня n- на более высокие, для спектров излучения - наоборот. В спектре водорода
n = 1 – серия Лаймана
n = 2 - серия Бальмера;
n = 3 - серия Пашена;
n. = 4 - серия Брэкета;
n = 5 - серия Пфунда;
n = 6 - серия Хемфри.
Схемы уровней энергии в атоме водорода и расположение серий его спектральных линий приведены на рис. 2. Каждому значению квантового числа n в формуле (6) соответствует граница серии с наибольшей частотой νmax или наименьшей длиной волны λmin (при n'= ∞ ). Величина Tn =1/λmin минимальной длине волны, называется термом. Значения терма вычисляются по формулам
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.