группы периодической системы
Состояние электрона в атоме однозначно определяется четырьмя квантовыми числами n, l, me и ms . Согласно принципу Паули в одном и том же атоме не может быть более одного электрона с одинаковым набором этих четырех квантовых чисел. Совокупность электронов с одинаковым главным квантовым числом n называется электронной оболочкой. Принцип Паули определяет закон заполнения электронных оболочек. Согласно (3) число возможных ориентации момента импульса Мl электрона на данной оболочке равно n2. Кроме того, каждой ориентации Мl может согласно (14), соответствовать 2 способа ориентации спина Ms, . Таким образом, максимально возможное число электронов на данной оболочке равно 2n2 . При этом для замкнутых (полностью заполненных электронами оболочек) суммарный момент импульса и суммарный спин равен нулю. Поэтому свойства атома характеризуются моментами импульса и спинами электронов незаполненных (валентных) оболочек. У атомов второй группы периодической системы [Zn, Cd, Нg] на внешней оболочке находятся два электрона.
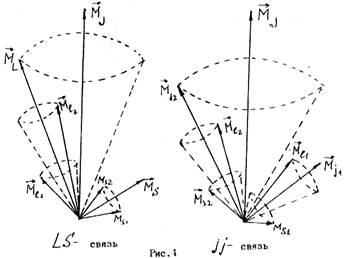
Орбитальные и спиновые моменты валентных электронов складываются по законам пространственного квантования, образуя вектор Мj полного момента импульса. Результат такого сложения зависит от порядка суммирования. Обычно рассматривают две модельные ситуации:
1) суммируют отдельно орбитальные и спиновые моменты электронов, а затем определяют суммарный момент импульса;
2) суммируют орбитальный и спиновый момент каждого электрона, а затем находят сумму по всем электронам.
Векторные модели для обоих случаев приведены на рис. 4. В большинстве случаев имеет место связь первого рода ( LS -связь или рессель-сандеровская связь). Числовые значения результирующих моментов импульсов в этом случае определяются выражениями:
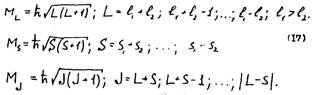
Здесь L и S - суммарные орбитальное и спиновое квантовые числа ; J - квантовое число полного момента импульса
Состояния атома с различными значениями квантового числа полного момента импульса J характеризуются различными взаимными ориентациями орбитальных и спиновых моментов и поэтому обладают различной энергией. Согласно (I7) число возможных значений J равно (2S+1) означает, что уровень энергии с данными L. и S расщепляется на (2S+1) подуровней. Число подуровней называется мультиплетностью.
Энергетические уровни (состояния) электронов в многоэлектронных атомах так же как для атома водорода характеризуют термами, т.е. величинами, обратными минимальным длинам волн излучения при переходах электронов с данного уровня.
|
|
Терм обозначают как где n - главное квантовое число; Т - буквенное обозначение суммарного орбитального квантового числа L , приведенное в табл. 3 J - квантовое число полного момента импульса;
2S+1 -мультиплетность.
Таблица 3
|
Значение суммарного i орбитального квантового числа L |
0 |
1 |
2 |
3 |
4 |
5 |
|
Буквенное обозначение |
S |
Р |
D |
F |
G |
H |
Например, термы 63P0 , 63P1 , 63P2 относятся к состояниям с одинаковыми n = 6, L = 1 и S = 1, но различными ,J, равными 0,1,2, т.е. данный терм является триплетом. В системе из двух электронов S может быть равно 0 или I (см.(17)), следовательно, мультиплетность принимает значения I и 3, т.е. образуются уровни-одиночки (синглеты) и триплетные уровни.
В работе исследуется спектр излучения паров ртути. На рис. 5 изображены схема энергетических уровней атома ртути и возможные переходы между ними. При переходах выполняются кваятово-механичес-. кие правила отбора
![]()
В нормальном состоянии оба валентных электрона являются 6S электронами, так как n = 6, a l=0.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.