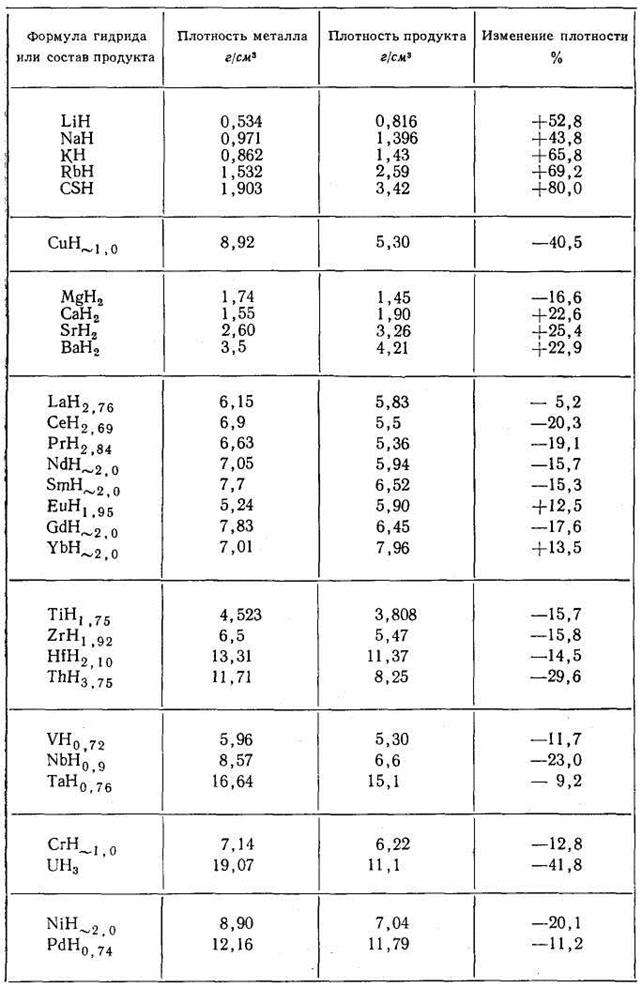
Эти данные показывают, что образование ионных гидридов щелочных и щелочноземельных металлов, в которых водород присутствует в виде отрицательного иона Н -, сопровождается значительным увеличением плотности по сравнению с чистым металлом. Образование гидридов, в которых ион водорода положителен (протон), и установлено наличие химической связи, также вызывает столь же значительное уменьшение плотности (UH3 и, по-видимому, ThH4).
При рассмотрении химических соединений водорода с металлами следует учитывать, что широко распространенное деление металлов на «гидри-дообразующие» и «не образующие гидридов», на «растворяющие» и «не растворяющие» и т. д. является чисто искусственным, не соответствующим истинной физической сущности процесса, и обусловлено тем, что и отдельные явления и вся совокупность процессов в целом недостаточно изучены. Точно так же искусственным является деление металлов на «экзотермически окклюдирующие» и «эндотермически окклюдирующие» водород. Оба процесса (и с выделением, и с поглощением тепла) свойственны всем металлам. Но для одних металлов, к которым принадлежит большинство, в исследованной области температур лежит лишь одна часть кривой — ее эндотермическая или экзотермическая ветвь, а обратный процесс либо протекает в весьма узком интервале температур, либо имеет место при температурах, выходящих за пределы изученных. Для других же металлов в изученном интервале температур находятся оба возможных процесса, и тогда на кривой растворимости наблюдаются экстремальные точки.
Из вышепоказанного следует, что особенности химического взаимодействия водорода с другими элементами соответствуют положениям этих элементов в периодической системе, по всем остальным видам взаимодействия также наблюдается отчетливая аналогия в поведении элементов, близких друг к другу по своем атомному строению.
Все многообразие процессов взаимодействия водорода с различными элементами обусловлено при прочих равных условия особенностями атомной структуры данного элемента в данных конкретных условиях. А структура, в свою очередь, зависит от таких внешних факторов, как температура, давление и др.
Таблица 5. Характер изменения плотности металлов при взаимодействии с водородом
2. Водород в стали
2.1 Растворимость
Растворимость водорода в техническом железе зависит от состава сплава, температуры и давления водорода. С понижением температуры растворимость падает и в жидком, и в твердом состоянии (рис. 15), причем в точке перехода из жидкого состояния в твердое она изменяется скачкообразно. В твердом состоянии водород внедряется в α - и γ - решетку, т. е. образует твердые растворы внедрения. γ - железо способно растворять водорода больше, чем α - или δ - железо. Поэтому переходы железа из δ - в γ - и γ - в α - состояние отмечаются скачкообразными изменениями растворимости. Во всех фазах растворимость изменяется по логарифмическому закону в функции обратных значений температуры (рис. 15).
|
|
|
Рис. 15. Растворимость водорода в железе в зависимости от температуры при атмосферном давлении. |
Растворимость водорода в железе пропорциональна квадратному корню из давления водорода. Соответствующие величины приведены на рис. 16, на котором представлена зависимость растворимости от температуры для различных давлений, полученная пересчетом из экспериментальных данных для давления 1 ат. Такая зависимость справедлива, конечно, только тогда, когда может быть достигнуто равновесие и прежде всего при высоких температурах. При низких температурах, порядка комнатной, кажущаяся повышенная растворимость может быть обусловлена образованием соединений или выделением водорода в пустоты.
|
|
|
Рис. 16. Растворимость водорода в железе при различных давлениях (получено расчетом). |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.