Часто в прописях используют понятие " процентный раствор"; оно не совсем точно. Строго говоря, процент - это одна сотая часть среди качественно одинаковых частей. Поэтому когда говорят о 3% растворе, формально следует понимать такой раствор, в 100 г которого содержится 3 г данного вещества и 97 г каких-то других составных частей. Однако в химической литературе иногда неправильно называют процентным та кой раствор, в 100 мл которого содержится 3 г данного вещества. Молярные растворы действительно готовят так, чтобы 1 л содержал столько-то молей растворенного вещества; этот принцип неправильно распространяют и на процентные растворы.
Иногда используют понятие «объёмные проценты», которое предполагает, что данный раствор получен путём смешивания А объёмов растворенного вещества и 100 – А объёмов растворителя. В связи с тем, что при смешивании жидкостей суммарный объём смеси обычно меняется, такой способ выражения нельзя считать удачным. Правильнее обозначать соотношение частей знаком «двоеточие» (:). Так, запись «вода: спирт: ацетон 1:2:2 «означает, что данная смесь получена путём смешивания 1 объёма воды, 2 объёмов спирта и 3 объёмов ацетона.
Некоторые работники, пытаясь сэкономить время, при приготовлении раствора насыпают навеску непосредственно в мерную колбу, растворяют её там и доводят объём до метки. Так можно поступать лишь в исключительных случаях, так как мерная посуда значительно дороже немерной, а когда насыпают вещество через узкое горлышко, а затем перемешивают и нагревают для растворения, колбу легко разбить.
Навеску растворяют в широкогорлой колбе или в химическом стакане в количестве растворителя, которое составляет от 30 до 80 % окончательного объема, а затем переливают в мерную колбу, споласкивают посуду, в которой готовили раствор, новой порцией растворителя, добавляют его в мерную колбу, а затем уже доводят до метки.
Определение рН. Буферные растворы.
Все химические реакции, с которыми приходится сталкиваться специалисту клинической лабораторной диагностики, проходят в водных средах, а молекула воды диссоциирует с образованием ионов водорода и гидроксила: Н2O=H++ОН-, которые всегда присутствуют в водных растворах, влияя почти на все химические реакции, соответственно, сказываясь на результатах аналитических процедур. Неправильная концентрация водородных ионов - самая распространенная причина, по которой методика «не идет».
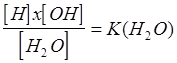 |
Величина константы зависит от температуры, с увеличением которой она также возрастает. При комнатной температуре (20 °С) произведение концентраций водородных и гидроксильных ионов составляет 0,86 10-14, при 37°С возрастает до 3,13 10-14. Так как общая концентрация воды в растворах высока - около 55 моль/л и постоянна, увеличение температуры приводит к тому, что возрастают концентрации как водородных, так и гидроксильных ионов.
Если в растворе больше водородных ионов, чем гидроксильных, такой раствор называется кислым; если больше гидроксильных ионов, его называют щелочным; если концентрации обоих ионов одинакового порядка - раствор нейтрален. По сложившейся традиции, указывается концентрация водородных ионов. В очень кислых растворах их концентрация может достигать 1 или даже несколько молей на литр, но в нейтральных или щелочных средах она ничтожно мала, измеряясь значениями 10 в степени до минус 14. Такими величинами оперировать неудобно, поэтому вместо концентраций, выраженных в молях/л, используют отрицательные значения их десятичных логарифмов. Так как концентрации всегда меньше 1, их логарифмы отрицательные, знак минус просто отбрасывают. Эта величина называется показателем концентрации водородных ионов, или сокращенно рН.
В нейтральных растворах рН около 7 - в крови здоровых людей он колеблется в пределах 7,25-7,35. Кислыми называют растворы, рН которых ниже 5 - на вкус они действительно кислые, щелочными те, где рН выше 8.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.