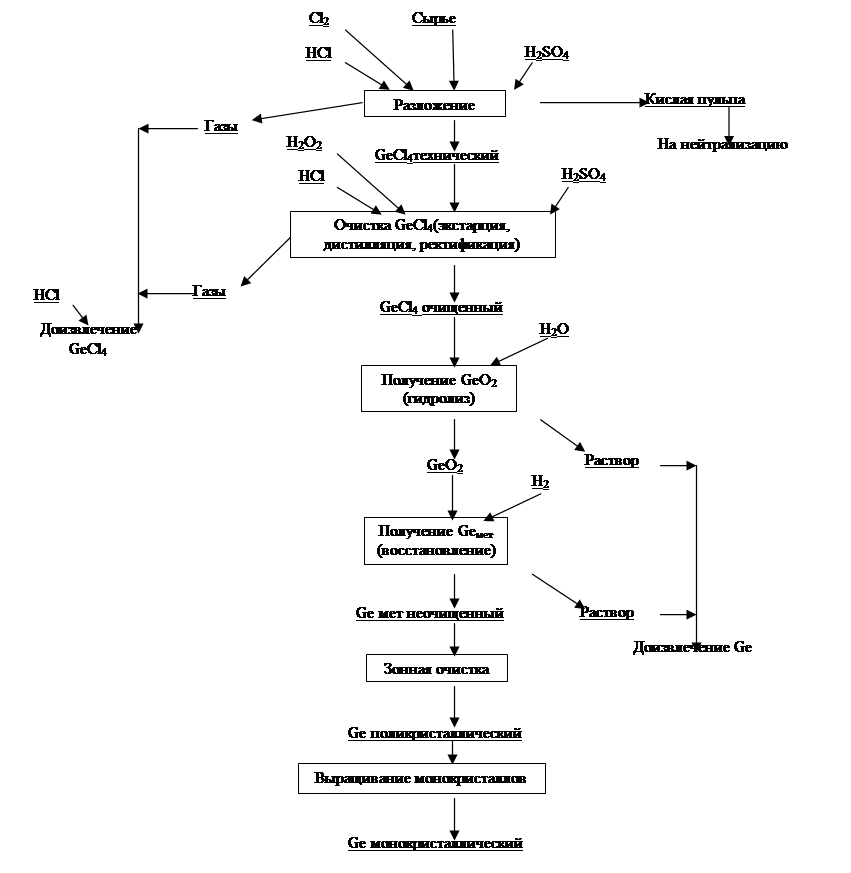
Рисунок 1.1 – Общая технологическая схема переработки германиевого сырья
1.5.1 Получение технического тетрахлорида германияиз германиевых концентратов
Особенность разложения определяется составом сырья и количеством содержащегося в нем диоксида германия.
Общее правило: чем больше германия в сырье, тем больше соотношение соляной кислоты и концентрата, требующихся для переработки. Это положение обусловлено тем, что чем больше концентрация германия в сырье, тем больше соляной кислоты расходуется на образование тетрахлорида германия и выводится в виде хлорида[5].
Технология хлорирования различного вида сырья неодинакова, в результате чего представляется возможным разделить их на три группы:
1) продукты, содержащие германий в окисленном виде (концентраты и кеки);
2) отходы, содержащие германий в виде мелкодисперсного металлического порошка (шлифпорошки);
3) кусковые отходы металлического германия.
Общая схема получения технического тетрахлорида германия из различных видов сырья представлена на рисунке 1.2.
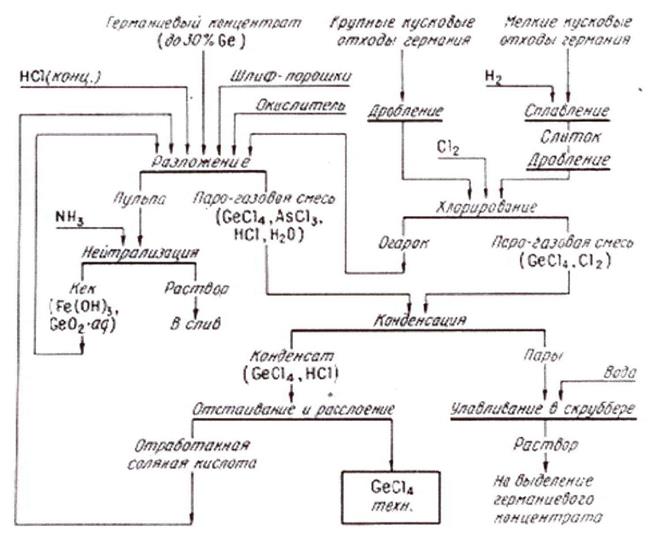
Рисунок 1.2 – Общая схема получения технического тетрахлорида германия из германиевых концентратов и отходов.
Переработка концентратов и кеков. Извлечение германия из концентратов и кеков основано на обработке их соляной кислотой, при этом пульпу медленно нагревают до 105¸110 °С, германий переходит в тетрахлорид по реакции:
GeO2 + 4HCl ® GeCl4 + 2H2O (1.3)
При концентрации соляной кислоты более 6,5 N равновесие в этой системе сдвинуто в сторону образования тетрахлорида германия. Процесс разложения концентратов обычно начинают в 11¸12 N HCl при весовом соотношении Т:Ж = 1:5 с тем, чтобы конечная кислотность не оказалась ниже 6,5¸7 N. Для растворения же диоксида германия и перевода его в тетрахлорид не требуется большого количества кислоты. Значительный ее избыток обусловлен составом концентратов, в которых основная доля приходит на оксиды (Fe2O3, Al2O3, CaO, MgO, As2O3 и др.). В конце процесса для поддержания оптимальной кислотности добавляют серную кислоту. Введение соляной кислоты для этих целей нежелательно из-за большого увеличения объемов раствора.
Отличительная особенность переработки продуктов содержащих германий в окисленной форме - сравнительная лёгкость перевода в хлориды (мелкодисперсный материал растворяется уже при комнатной температуре и через 40 минут основное количество GeO2 переходит в раствор)[5,6]. Нагревание способствует ускорению и полноте растворения: при температуре 90¸100 °С процесс протекает втрое быстрее.
Используя растворимость GeO2 в соляной кислоте и летучесть тетрахлорида германия, можно достаточно полно перевести германий в хлорид, попутно отделив дистилляцией от многих элементов, составляющих концентрат. На рисунке 1.3 представлены данные о растворимости германия в соляной кислоте.
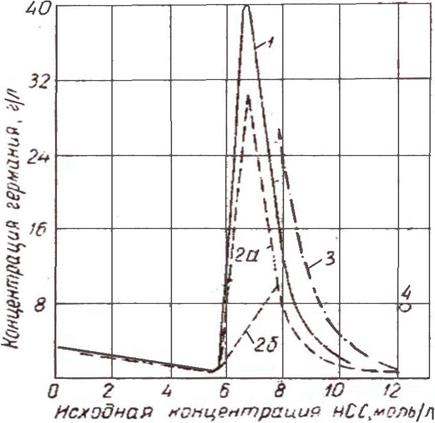
1 - данные Н.Н Мурача, В.В. Крапухина при 20о С; 2а, 2б - данные Эвереста и Гаррисона при 25о С для GeCl4 и GeO2 соответственно; 3 - данные Аллисона и Мюллера при 25 оС;
4 - данные Моррисона, Дорфмина и Косгрова при 25 оС
Рисунок 1.3 – Растворимость GeCl4 в соляной кислоте
Температуры кипения хлоридов некоторых сопутствующих элементов представлены в таблице 1.1[5].
Таблица 1.1 - Температуры кипения хлоридов
|
Хлорид |
GeCl4 |
BCl3 |
SiCl4 |
CCl4 |
AsCl3 |
TiCl4 |
SiO3Cl6 |
AlCl3 |
|
Ткип, оС |
83,1 |
13 |
57,6 |
75,9 |
130 |
136,4 |
137 |
178 |
|
Хлорид |
SnCl4 |
SbCl3 |
FeCl3 |
BiCl3 |
ZnCl2 |
CuCl2 |
MnCl2 |
MgCl2 |
|
Ткип, оС |
114,1 |
220,2 |
315 |
447 |
732 |
993 |
1190 |
1412 |
Содержание мышьяка в конденсате может доходить до нескольких процентов вследствие высокой упругости паров AsCl3 при 80¸110 оС. Зависимость давления пара от температуры представлена на рисунке 1.4[5].
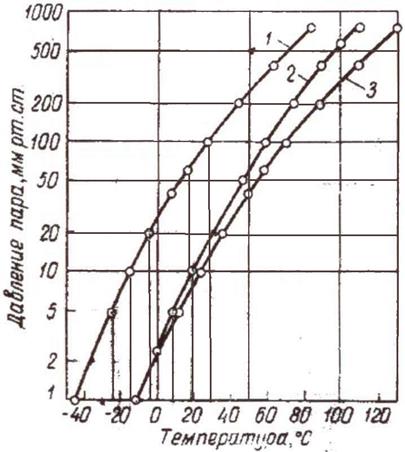
1 - GeCl4; 2 - 20% HCl; 3 - AsCl3
Рисунок 1.4 – Давление пара при различных температурах
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.