Простая дистилляция не обеспечивает очистки тетрахлорида германия от мышьяка до чистоты, необходимой для полупроводниковых целей. Система имеет некоторое отрицательное отклонение от идеальной. Диаграмма «температура – состав» смесей GeCl4 и AsCl3 представлена на рисунке 1.5. Система имеет некоторое отрицательное отклонение от идеальной. В области концентраций треххлористого мышьяка от 6,3×10-6 до 5% (мол.) относительная летучесть хлоридов постоянна и равна 2,52±0,35[5].
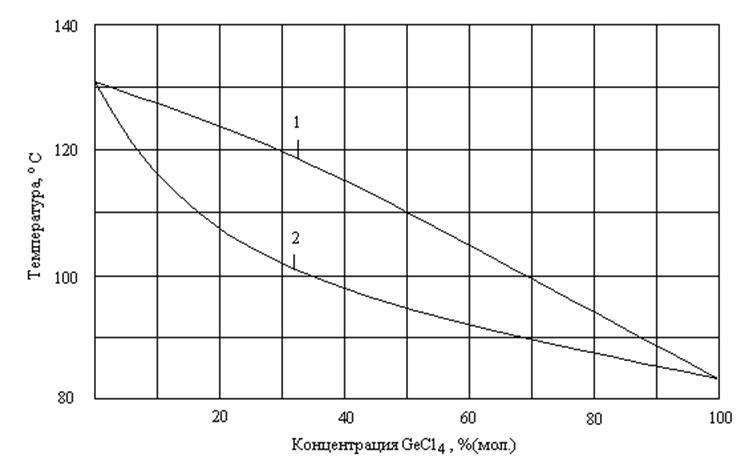
1 – линия пара; 2 – линия жидкости.
Рисунок 1.5 – Диаграмма «температура – состав системы GeCl4 – AsCl3»
Процесс дистилляции осуществляется из-под слоя разбавленной до 75% серной кислоты в двух дистилляционных колоннах, работающих поочередно. Дистиллируясь, пары очищаются от примесей. Сбор дистиллята осуществляется в стеклянные емкости. Дистиллят направляют на экстракцию[8].
Очистка экстракцией
Экстракция тетрахлорида германия соляной кислотой – очистка тетрахлорида германия от примесей, главным образом, от мышьяка, после его предварительного окисления до пятивалентного состояния.
Процесс основан на разной степени растворимости примесей и хлорида германия в соляной кислоте. Процесс осуществляется крепкой хлорированной соляной кислотой. Исследование влияния температуры показало, что при 0 оС в соляной кислоте содержится вдвое меньше GeCl4, чем при 25 оС[5]. Кроме того, в результате снижения температуры при экстракции концентрированной соляной кислотой уменьшается летучесть хлористого водорода и выделение газов при перемешивании.
Глубокая очистка однократной экстракцией от хлоридов Ti4+, Sb5+ и Sn2+ происходит вследствие образования этими веществами комплексных соединений типа H2MeCl6 не растворимых в GeCl4. Ацидокомплексы образуются также хлоридами Sb3+ и Sn4+, а очистка от SiCl4, PCl3 и BCl3 идет за счет гидролиза этих соединений даже в концентрированной соляной кислоте. Практически степень очистки тетрахлорида германия от этих соединений определяется чистотой применяемых реактивов и аппаратуры[9].
Более поздними исследованиями обнаружено, что эффективность очистки от мышьяка повышается в присутствии окислителей. Предложен и обоснован способ экстракции соляной кислотой с хлором, при котором протекает реакция[6]:
AsCl3 + 4H2O + Cl2 = H3AsO4 + 5HCl (1.15)
Окисление проводится с целью перевести треххлористый мышьяк в мышьяковую кислоту, которая практически не растворима в GeCl4. В свою очередь с уменьшением концентрации AsCl3 в соляной кислоте повышается извлечение его из тетрахлорида германия.
Экстракция осуществляется в установке непрерывного действия, состоящей из трех аэролифтных аппаратов, смесителя соляной кислоты и пергидроля, дозирующих устройств.
Хлор для окисления мышьяка образуется при взаимодействии соляной кислоты и пергидроля по реакции:0
2HCl + H2O2 = 2H2O + Cl2 (1.16)
Для очистки тетрахлорида германия экстракцией могут быть применены также органические растворители: четыреххлористый углерод, бензол, хлороформ и смеси углеводородов. При этом используется различное распределение GeCl4 и хлоридов примесей между органической жидкостью и соляной кислотой. Из растворов 9N и 12N соляной кислоты в четыреххлористый углерод переходит Ge4+ на 100%, AsCl3 на 60 ¸75%, Sn4+ на 0,001%, Sb5+ на 0,001¸0,1%, Se4+ на 0,01¸0,1%. В CCl4 хорошо экстрагируется треххлористый мышьяк, а Sb3+ и Sn3+ имеют коэффициенты распределения 0,0001¸0,00001, т.е. могут быть полностью отделены от германия[9].
Соляная кислота в органических соединениях растворяется незначительно. Например, коэффициент распределения HCl в CCl4 составляет 4,5×10-4. Можно использовать при экстракции смесь соляной и серной кислот с добавлением хлоридов натрия, калия и кальция, так чтобы общая кислотность была не ниже 8 г-ион/л. Высаливающее действие этих добавок способствует переходу GeCl4 в органические растворители. Однако эти методы не имеют самостоятельного значения для очистки четыреххлористого германия. Основное их назначение - извлечение GeCl4 из бедных солянокислых растворов с последующей реэкстракцией и получением технической диоксида германия.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.