т.к. концентрация перекисных радикалов велика, то они в первую очередь будут реагировать с ними, а при таком обрыве цепей образуются молекулы гидроперекиси, которая является вырожденным разветвляющим агентом.
И даже если концентрация ингибитора достаточна для того, чтобы уменьшить длину кинетических цепей до нуля, но образующаяся гидроперекись снижает их эффективность.
ингибиторы участвуют в вынужденном разветвлении цепей, реагируя с гидроперекисью. Скорость распада гидроперекисей значительно возрастает в присутствии веществ, содержащих подвижные водороды.
Пример: взаимодействие гидроперекиси ПП с α-нафтолом протекает настолько быстро, что скорость процесса лимитируется только скоростью диффузии α-нафтола в зону реакции.
Рассмотренные процессы обуславливают существование не только нижней (минимальной) критической концентрации, но и верхней (максимальной), при превышении которой процесс выходит из-под контроля и становится лавинообразной.
Т.о., условие стационарности процесса: [IH]кр. нижн < [IH] <[IH]кр. верхн
Разветвляющий агент образуется по следующей схеме:
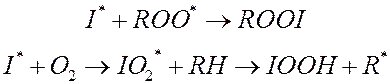 |
Реакции с кислородом протекают очень легко, даже если радикал неактивен.
ограниченная растворимость в полимере, неоднородность распределения, летучесть, вымываемость, выпотевание, окрашивание полимеров продуктами распада полимера (хиноидными структурами).
Со всеми перечисленными недостатками можно успешно бороться, что и обуславливает широкое применение ингибиторов.
Подавление вырожденного разветвления и инициирования
Достигается введением веществ, разрушающих инициаторы и разветвляющие агенты (путём реакции с гидроперекисями без образования радикалов).
Для подавления разветвления кинетических цепей гидроперекиси разрушаются по нерадикальному механизму (без образования радикалов), для этого добавки должны быстро реагировать с гидроперикисями, не допуская их разрушения.
Для этих целей используются сульфиды, дисульфиды, эфиры фосфористой кислоты (фосфиты):
O
R-S-R + ROOH → R-S-R + ROH
(сульфид, сульфон
дисульфид) O
![]()
R-S-R + ROOH → R-S-R + ROH
O
Фосфиты по аналогичной схеме окисляются до фосфатов:
фосфит + ROOH → фосфат + ROH
![]() (PhO)3P
+ ROOH → (PhO)2P-OR + PhOH
(PhO)3P
+ ROOH → (PhO)2P-OR + PhOH
O
(PhO)3P – трифенокси фосфит.
Также легко протекает реакция:
(PhO)3P + ROO* → (PhO)2P-OR + OR
O
Недостатки: склонность фосфатов и сульфатов к цепному самоокислению в ходе побочных реакций – перерасход стабилизатора (хотя именно это свойство обуславливает их действие как ингибиторов).
![]()
![]() (PhO)3P
+ ROO* → (PhO)2P *- OOR → (PhO)3P
+ RO*
(PhO)3P
+ ROO* → (PhO)2P *- OOR → (PhO)3P
+ RO*
O O
RO* + (PhO) 3P → ROP * (PhO3) → R* + (PhO)3P
O
R* + O2 → ROO*
Совместно со стабилизаторами рационально использовать ингибиторов радикальных частиц, которыми обычно являются амины или фенолы (ингибитор устраняет радикалы, что сохраняет стабилизатор, а он в, свою очередь, разрушает гидроперекиси – сохраняет ингибитор). На этом основано явление синергизма.
Структурно-физические принципы стабилизации
Химическая стабилизация применяется при следующих условиях:
1. скорость обрыва ц
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.