12. КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ
В начале следует, наверное, напомнить, что такое координационные или комплексные соединения. К таким соединениям относят соединения, содержащие центральный атом и группу окружающих атомов (ионов, молекул), связанных с ним. Валентность центрального атома (ион переходного металла) больше общепринятой является кажущейся и называется координационным числом. Комплексные соединения подразделяют на солеобразные ([Co(NH3)6]Cl3; K3[Fe(CN)6]) и карбонилы металлов (Cr(CO)6). Окружающие центральный атом лиганды - ионы, полярные молекулы, молекулы, имеющие неподелённую электронную пару. Лиганды подразделяются на монодетантные (NH3; CN-), бидетантные (этилендиамин - NH2CH2-CH2NH2), тридетантные (диэтилентриамин - NH2CH2-CH2NHCH2-CH2NH2). Когда оба донорных атома соединены с одним атомом металла, образуя кольцевую систему, соединение называется хелатным.
Связи в комплексных соединениях подразделяются на: ион-ионная, ион-дипольная, донорно-акцепторная, дативная. Дативная связь - это дополнительная донорно-акцепторная связь p-типа, в которой низко расположенные вакантные разрыхляющие p*-орбитали лиганда заполняются электронной парой d-орбитали центрального атома.
12.1. d-орбитали.
Как уже говорилось выше, имеется 5 линейно независимых d-функций с одним и тем же значением главного квантового числа n = 3. Однако, на первый взгляд, можно представить большее число d-функций:
dxy; dyz; dxz; dx2- y2; d z2- x2; dy2- z2. (12.1)
![]() Эти функции эквивалентны по форме и имеют 4
сходные области с чередующимися знаками, разделённые узловыми плоскостями.
Кроме того, орбитальные плоскости совпадают с координационными плоскостями.
Следует отметить, что три последние в 12.1 АО не независимы друг от друга, ибо:
Эти функции эквивалентны по форме и имеют 4
сходные области с чередующимися знаками, разделённые узловыми плоскостями.
Кроме того, орбитальные плоскости совпадают с координационными плоскостями.
Следует отметить, что три последние в 12.1 АО не независимы друг от друга, ибо:
Y(dx2- y2) + Y(d z2- x2) + Y( dy2- z2) = 0. (12.2)
Это можно показать как графически, так и аналитически. Т.о. для описания d-орбитали достаточно взять только две из трёх волновых функций из 12.2. Другим важным условием используемых волновых функций является их ортогональность. В 12.1 первые четыре ортогональны друг другу, но последние две ортогональны первым трём, но не ортогональны четвёртой. Задача: найти пятую функцию, ортогональную первым четырём. Такую функцию можно найти линейной комбинацией из двух последних 12.2:
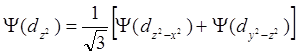 .
.
После нормировки:
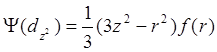 .
(12.3)
.
(12.3)
Итак, в качестве пяти базисных волновых d-функций можно выбрать следующие орбитали:
dxy; dyz; dxz; dx2- y2; d z2. (12.4)
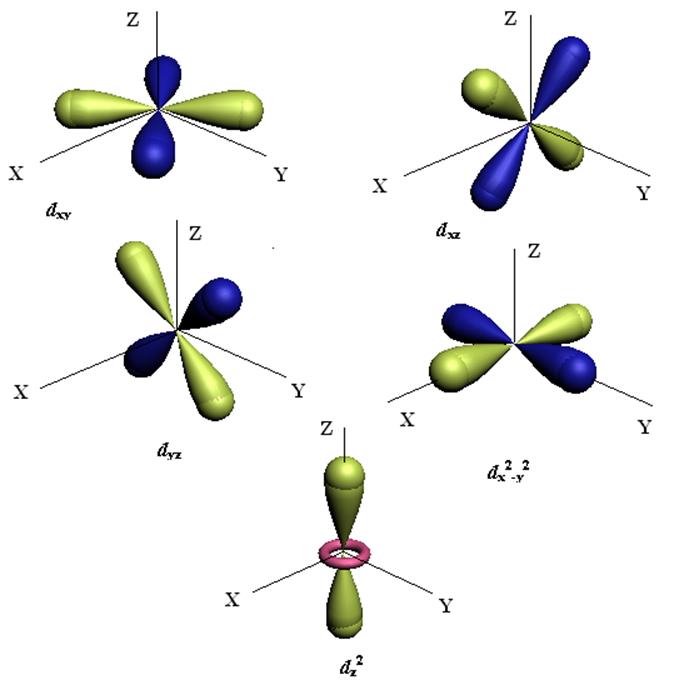
Рис.12.1. Схематические диаграммы пяти d-орбиталей.
Направление оси Z определяетя соображениями удобства. Именно вдоль оси Z прикладывают электрическое или магнитное поля. Орбиталь dz2 обладает аксиальной симметрией. Все пять d-функций соответствуют одной и той же энергии (в отсутствии внешнего поля). Набор 12.4 представляет собой простейшую ортогональную систему. Можно выбрать и другие комбинации первоначальных шести функций.
К d-элеметам относятся следующие: Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, Os, Ir, Pt и др.
12.2. d-электроны в атомах переходных элементов.
Переходные элементы образуют большое число разнообразных комплексов от ионных [FeF6]3- (ион-ионная связь) до гидратных [Ti(H2O)6]3+ (ион-дипольная связь). Это обусловлено отличием этих элементов от других, а именно, наличием у них d-электронов. В связи с этим возникают вопросы: 1) Как распределены электроны в свободных атомах; и 2) Как влияет на это распределение присутствие окружающих групп, расположенных вокруг атома в определённом порядке. Такие группы, как известно, называются лигандами. При переходе от Sc к Cu в первом большом периоде постепенно заполняется подслой 3d, а в центре находится аргоноподобный остов. В начале ряда 4s-электрон связан прочнее, чем 3d-электрон. Слева направо энергетический уровень 3d-электронов опускается ниже уровня 4s-электронов. Т.о. средний размер облака зарядов 4s и 3d должен быть приблизительно одинаков для атомов в начале ряда, но для конца ряда облака 3d-электронов становятся более сжатыми, чем облака 4s-электронов. Одно из основных условий гибридизации орбиталей является близость энергий АО между собой. У тяжёлых элементов орбитали d-типа имеют энергии, близкие к энергиям к s- и р-орбиталям следующего слоя, т.е. 3d к 4s и 4р. При подходящей комбинации этих орбиталей могут быть получены очень чётко направленные гибридные АО, дающие соответствующее координационное число и определённые валентные углы. Например, гибридные АО октаэдрического типа возникают за счёт sp3d2-гибридизации. Положительная октаэдрическая АО вдоль оси X описывается следующей волновой функцией:
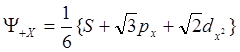 .
(12.5)
.
(12.5)
Октаэдрическая координация наблюдается, в основном, у элементов переходных групп. Этого и следовало ожидать, т.к. для образования гибридных АО необходимо наличие неполностью занятых d-орбиталей центрального атома. Даже, если для образования этих гибридных АО необходима затрата энергии, их появление объясняется способностью образовывать сильные связи. В рамках представлений Полинга и Шермана сила октаэдрической орбитали 2.924, в то время как для s-орбитали - 1.0, для р-орбитали - 1.732, для чистой dх2 -орбитали 2.236.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.