9. МНОГОАТОМНЫЕ МОЛЕКУЛЫ
Для нелинейных многоатомных молекул классификация МО ведётся по отношению к операциям симметрии, характерным для данной равновесной конфигурации молекулы. При этом при обозначении МО используются следующее обозначения: а – симметричные типы орбиталей, b – антисимметричные, е – дважды вырожденные, t – трижды вырожденные. Эти многоцентровые МО приближённо описываются как линейные комбинации атомных орбиталей всех атомов. В этом случае, казалось бы, нет места для локализованных двухцентровых связей. Однако, как показал Леннард-Джонс, для многоатомной молекулы волновая функция, построенная из делокализованных многоцентровых МО, в определённых случаях может быть математически преобразована в функцию, построенную из двухцентровых локализованных МО. В тех случаях, когда это возможно, целесообразнее пользоваться локализованными МО, поскольку они нагляднее и с ними легче оперировать. Локализованные МО позволяют сохранить идею химической связи между двумя атомами (историческую, наглядную, привычную), традиционную символику А-В, А-В-С и т.п. Однако, локализованные МО совершенно неприменимы для описания сопряжённых связей, связей в ароматических и координационных соединениях, а также для описания электронно-возбуждённых состояний молекул. Для многоатомных нелинейных молекул также принято подразделение МО на s, p и d, но в отличие от линейных молекул оно не связано с квантовым числом l, а только с формой электронного облака МО.
9.1. Локализованные МО.
Следует отметить, что метод делокализованных МО не может объяснить постоянства свойств связи между конкретными атомами. Так, например, в атоме метана СН4, учитывая электронную конфигурацию углерода, можно предположить, что 2 электрона К-оболочки углерода не участвуют в образовании связи, а остальные 8 электронов (4 от углерода 2s2 и 2р2 и 4 от атомов водорода 1s) занимают многоцентровые МО, охватывающие все 5 ядер. Однако такой подход не позволяет понять почему в других соединениях свойства связи С-Н (длина, энергия связи, полярность, частота колебаний) остаются практически постоянными. На рис.9.1 показаны схемы локализованных и делокализованных связей для метана.
Наличие характеристических (малоизменяющихся) свойств предполагает локализацию заряда на связях, в то время как метод делокализованных МО подразумевает размазывание заряда по всей многоцентрвой конструкции. Эта трудность преодолевается введением двухцентровых МО, т.е. становится возможной трактовка части молекулы как двухцентровой системы. Энергетические данные подтверждают такую точку зрения. Так, например, для парафинов с формулой СnН2n+2 можно рассчитать энергию связи углеводорода с разным значением n, считая постоянными энергии связей С-С (80 ккал/моль = 3.5 эВ) и С-Н (98 какл/моль = 4.3 эВ). При этом полученные значения отличаются от экспериментальных на 1-2 ккал/моль. Сам факт существования данных по энергиям связей многоатомных молекул приводит к выводу о том, что связывающие электроны локализованы в пределах определённой связи.
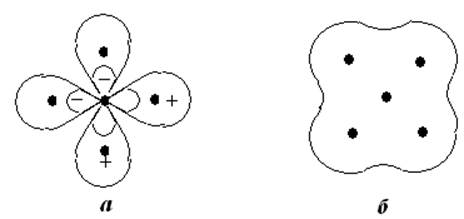
Рис.9.1. Локализованные (а) и делокализованная связи (б) в СН4.
На примере молекулы воды покажем применимость представлений о локализованных МО. Для построения МО используем две АО 1s-электронов от двух атомов водорода и две АО от кислорода - 2рx и 2рy. Электроны 1s2 атома кислорода сохраняют атомных характер. Из-за большой разности в энергиях 1s-орбитали атома водорода и 2s-орбитали атома кислорода можно пренебречь комбинацией между ними и считать, что 2s-электроны атома кислорода в молекуле Н2О образуют неподелённую пару (несвязывающую МО). Расположив АО 1s (Н*и Н**) и 2р (О) как показано на рис.9.2, мы получим две локализованные МО. Орбиталь 2pz атома кислорода в молекуле воды также играет роль несвязывающей МО и электроны на ней образуют вторую неподелённую пару.
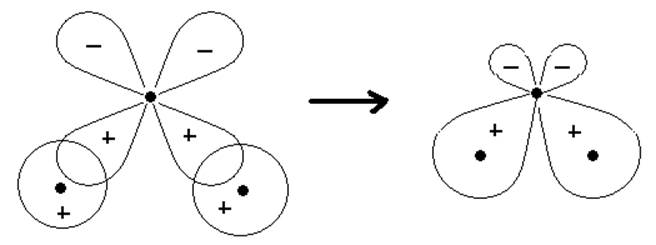
Рис.9.2. Образование локализованных МО для Н2О.
В первом приближении волновые функции локализованных МО Y1 = y(Н*) + ly(О:2рх) и Y2 = y(Н**) + ly(О:2рy) не зависят друг от друга. Поэтому, если в молекуле воды один атом водорода заменить на какой-либо другой, то волновая функция оставшейся локализованной МО Y2 изменится мало. Т.е. электроны связи О-Н имеют характеристические волновые функции, что является обоснованием постоянства свойств связи.
9.2. Направленная валентность.
В случае с молекулой воды приближённая независимость МО обусловлена выбором атомных орбиталей кислорода, которые перпендикулярны друг к другу и не перекрываются. Основное условие наличия локализованных связей здесь во взаимной ортогональности АО кислорода и в пренебрежении перекрывания орбиталей (Н*) и (Н**). В молекуле Н2О атомы водорода располагаются вдоль направлений р-орбиталей, т.е. по осям X и Y. Поэтому валентный угол Н-О-Н близок к 90O (104O). Соответствующий угол в молекуле H-S-H 92O. Всегда, когда центральный атом обладает двумя р-электронами, принимающими в образовании связи, валентный угол близок к 90O. Эти основы теории направленной валентности, которые являются фундаментом современной стереохимии, опираются, во-первых, на возможность использования локализованных МО и, во-вторых, на критерий максимального перекрывания. При трёх неспаренных р-электронах образуются три связи под (приблизительно) прямым углом друг к другу. В качестве примера можно привести молекулу аммиака NH3. Молекула аммиака, а также трёхвалентные соединения P и As должны иметь пирамидальную форму с углом при вершине » 90O. В действительности же угол между р-р-связями более 90O: Н2О - 104O 31¢, NH3 - 107O, РН3 - 94O, AsH3 - 92O, H2S - 92O. Возрастание валентного угла обусловлено следующими причинами:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.