Механизм реакции представляет собой совокупность трех процессов (А, В и С) (см. табл. 1). Принципиальной чертой механизма является конкуренция между Br– и BrO3– за HBrO2 (см. реакции (R2) и (R5) процессов А и В соответственно). Основу механизма ФКН составляет процесс В, который включает автокаталитическую стадию производства HBrO2. Процесс В может ингибироваться любым соединением, которое конкурирует с разветвленной цепью реакций HBrO2 (см. (R5) и (R6)). В классической системе БЖ таким соединением является Br–; именно Br– определяет, какой из процессов (А или В) доминирует в данный момент времени. Когда концентрация Br– достаточно велика, HBrO2 эффективно расходуется по реакции (R2), что предотвращает разветвление цепи и, таким образом, подавляет процесс В. Однако в результате протекания процесса А происходит удаление Br– из системы и атомы брома оказываются в конечном итоге связанными в молекулах органических соединений (см. образование BrMA в процессе А). Когда концентрация Br– в результате протекания процесса А достигает критической, достаточно малой величины, при которой реакция (R2) уже не может успешно конкурировать с реакцией (R5) процесса В за HBrO2, начинается автокаталитическое окисление в процессе В. Начало процесса В сопровождается быстрым производством окисленной формы катализатора M(n+1)+, которая в свою очередь расходуется в процессе С. Процесс С поставляет Br–, подавляющий процесс В, но в то же время способствует его возобновлению, так как снова восстанавливает M(n+1)+ в Mn+. Следующий цикл окисления начинается, когда в результате протекания процесса С будет восполнена концентрация Mn+, а концентрация Br– в процессе А доведена до величины ниже критического значения, необходимого для ингибирования процесса В. Таким образом, возникают повторяющиеся импульсы окисления.
Для механизма, состоящего из стадий (R4), (R5) и (R6) из табл. 1 с реакцией (R5) в качестве лимитирующей стадии скорость реакции имеет вид [15]
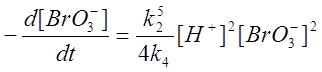 ,
,
где 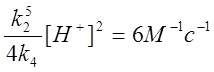 .
.
Простое выражение для скорости процесса С [5]
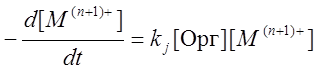 ,
,
где
![]() ≈ 1 М–1с–1 и
≈ 1 М–1с–1 и ![]() – общая концентрация органических
соединений в реакционной смеси, дает отличное описание восстановления M(n+1)+
до Mn+ в ходе колебаний БЖ.
– общая концентрация органических
соединений в реакционной смеси, дает отличное описание восстановления M(n+1)+
до Mn+ в ходе колебаний БЖ.
Механизм Филда–Кереша–Нойеса реакции Белоусова–Жаботинского (по [5, 14])
Процесс А |
|
|
Br– + BrO3– + 2 H+ ¾® HBrO2 + HOBr Br– + HBrO2 + H+ ¾® 2 HOBr 3 (Br– + HOBr + H+ ¾® Br2 + H2O) 3 (Br2 + MA ¾® BrMA + Br– + H+) |
(R3) (R2) (R1) (R8) |
|
2 Br– + BrO3– + 3 H+ + 3 MA ¾® 3 BrMA + 3 H2O |
(A) |
|
Процесс B |
|
|
BrO3– + HBrO2 + H+ ¾® 2 BrO2· + H2O 2 (Mn+ + BrO2· + H+ ¾® M(n+1)+ + HBrO2) 2 Mn+ + BrO3– + HBrO2 + 3 H+ ¾® 2 M(n+1)+ + H2O + 2 HBrO2 2 HBrO2 ¾® BrO3– + HOBr+ H+ 3 (Br– + HOBr + H+ ¾® Br2 + H2O) 3 (Br2 + MA ¾® BrMA + Br– + H+) |
(R5) (R6) (G) (R4) (R1) (R8) |
|
BrO3– +4 Mn+ + MA + 5 H+ ¾® 4 M(n+1)+ + BrMA + 3 H2O |
(B) |
|
ПроцессС |
|
|
M(n+1)+ + MA + BrMA + H2O ¾® Mn+ +f Br– + другие продукты |
(C) |
|
Примечание. Mn+, M(n+1)+ – катионы катализатора в разных степенях окисления; MA – малоновая кислота; BrMA – бромированные производные малоновой кислоты; f – стехиометрический фактор (количество Br–, произведенное на один ион M(n+1)+, восстановленный в процессе С). |
|
На механизме ФКН базируется упрощенная модель реакции БЖ – так называемый орегонатор Филда и Нойеса [14]:
A + Y¾® X; (O1)
X + Y ¾® P; (O2)
A + X ¾® 2 X + Z; (O3)
X + X ¾® Q; (O4)
Z ¾® f Y. (O5)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.