 |
|||
Определения
![]()
Молекулы образуются при объединении двух или более атомов
![]() Возникающее
устойчивое взаимодействие называется химической связью
Возникающее
устойчивое взаимодействие называется химической связью
Валентность (valentia — сила) – способность атома образовывать определенное число химических связей
![]()
Типы химических связей
Различают ионную и ковалентную связь
![]() Ковалентная (неполярная,
гомеополярная) – обобществление электронов
Ковалентная (неполярная,
гомеополярная) – обобществление электронов
![]() Ионная (полярная,
гетерополярная) – в пределе переход электрона от одного к другому атому.
Пример: NaCl
Ионная (полярная,
гетерополярная) – в пределе переход электрона от одного к другому атому.
Пример: NaCl
![]() Молекулярный ион водорода Н2+
Молекулярный ион водорода Н2+
![]() Методы
решения
Методы
решения
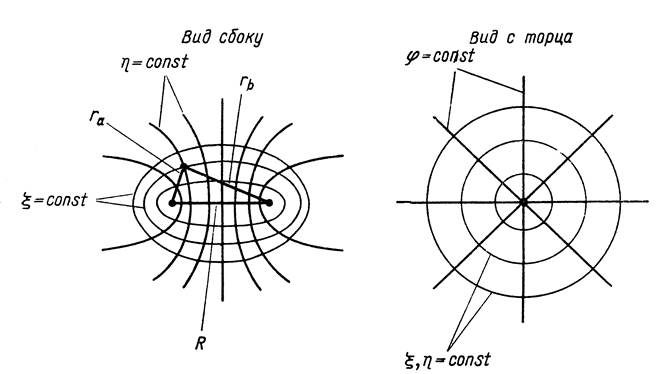
![]() Возможно аналитическое решение УШ с разделением
переменных в эллиптических координатах: x, h, j
Возможно аналитическое решение УШ с разделением
переменных в эллиптических координатах: x, h, j
|
![]() Метод
молекулярных орбиталей
Метод
молекулярных орбиталей
![]() Орбиталь – координатная частьволновой функции (напр, атомная n,
Орбиталь – координатная частьволновой функции (напр, атомная n, ![]() ,
, ![]() –орбиталь)
–орбиталь)
![]()
Молекулярная орбитальдля Н2+


|
|
|
|
|

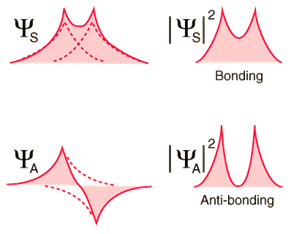
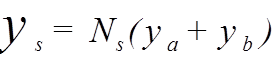 - симметричная,
- симметричная,
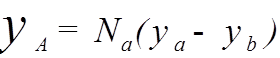 - антисимметричная
- антисимметричная

![]() Нормировка
Нормировка 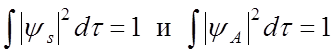 , дает
, дает
Ns = 1/2(1+Q) и NA = 1/2(1 - Q),
Интеграл
перекрытия![]()
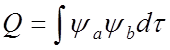 -.
-.
Для s-орбиталей
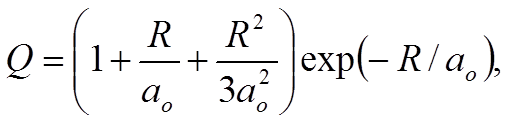
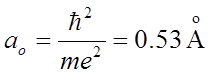 –
радиус Бора;
–
радиус Бора; 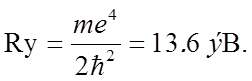
![]() Энергия
электрона W`в молекуле
Н2+
(из УШ (а.е.))
Энергия
электрона W`в молекуле
Н2+
(из УШ (а.е.))
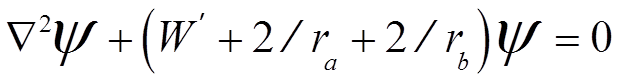 ,
,
умножив на ![]() * и проинтегрировав, получим:
* и проинтегрировав, получим:
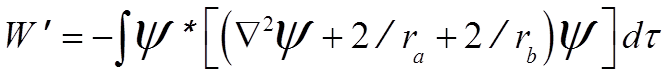 .
.
Подставив
найденные  , или
, или 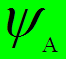 ,
получим:
,
получим:
![]()
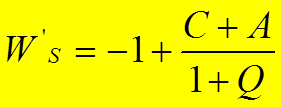 ,
, 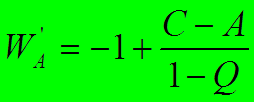 ,
,
![]()
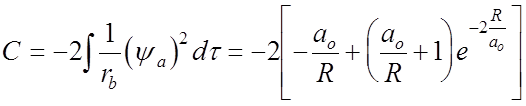 - кулоновский
интеграл,
- кулоновский
интеграл,
![]()
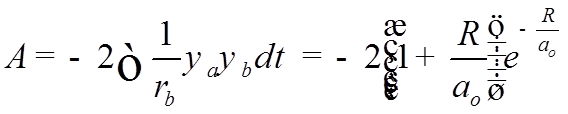 - обменный
интеграл.
- обменный
интеграл.
![]() Полная энергия молекулы Н2+
включает энергию взаимодействия протонов
Полная энергия молекулы Н2+
включает энергию взаимодействия протонов 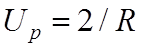 .
.
![]() Точное решение задачи
Точное решение задачи
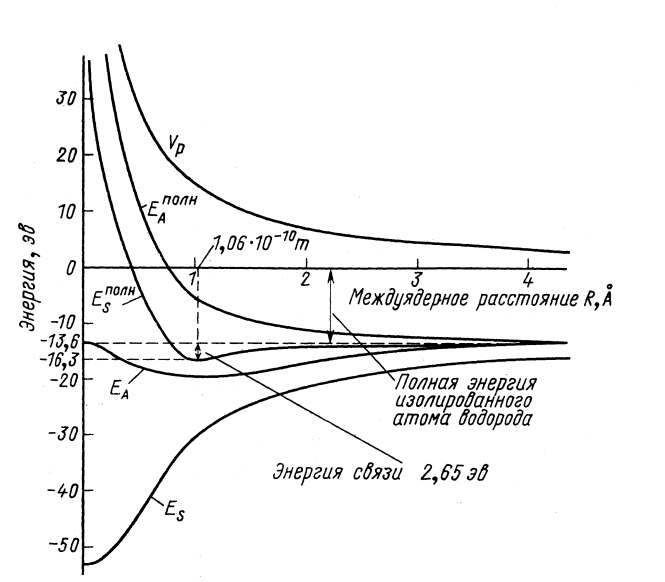
![]() Энергия химической связи
Энергия химической связи
![]() метод МО – 0.13
Ry (1.8 эВ) при
R* = 2.5 а0.
метод МО – 0.13
Ry (1.8 эВ) при
R* = 2.5 а0.
![]() точные значения – 0.195 Ry (2.65 эВ) и
R* = 2 а0.
точные значения – 0.195 Ry (2.65 эВ) и
R* = 2 а0.
 |
|||
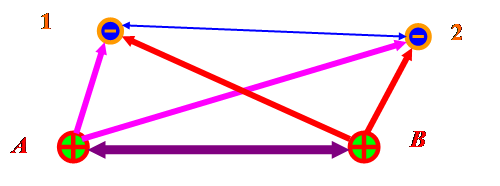
«Конструируем» молекулярную орбиталь для Н2
![]()
Имеем
атомные орбитали: ![]() ,
,
![]() «Строим» молекулярные орбитали:
«Строим» молекулярные орбитали:
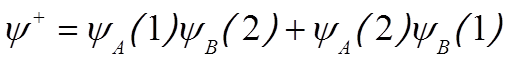 ,
,
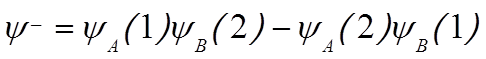 .
.
![]() Энергия электрона в молекулеН2
Энергия электрона в молекулеН2
![]() Гамильтониан:
Гамильтониан:
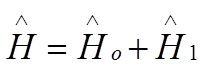 ,
,
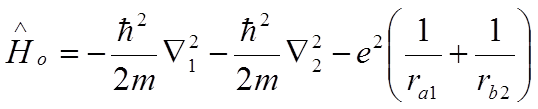 -
невозмущенная энергия двух атомов (предполагается
-
невозмущенная энергия двух атомов (предполагается ![]() в виде
в виде ![]() );
);
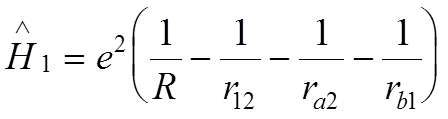 - взаимодействие протонов и электронов
между собой и электронов с “чужими” протонами.
- взаимодействие протонов и электронов
между собой и электронов с “чужими” протонами.
![]() По теории
возмущений:
По теории
возмущений: 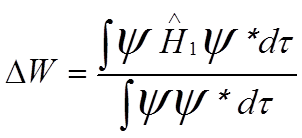 .
.
![]() Введем
Введем
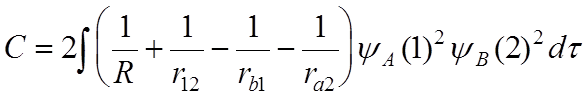 - кулоновский
интеграл,
- кулоновский
интеграл,
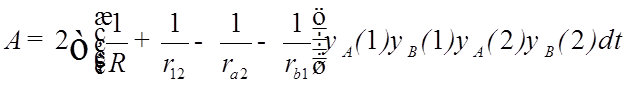 - обменный
интеграл
- обменный
интеграл
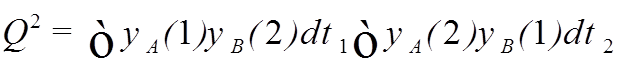 - квадрат
интеграла перекрытия
- квадрат
интеграла перекрытия
![]() Вычислив интегралы C; A; Q,
можно определить DW
Вычислив интегралы C; A; Q,
можно определить DW
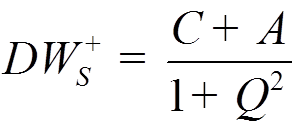
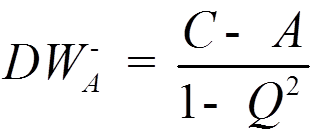 .
.
![]() Точное решение задачи
Точное решение задачи
![]()
|
|
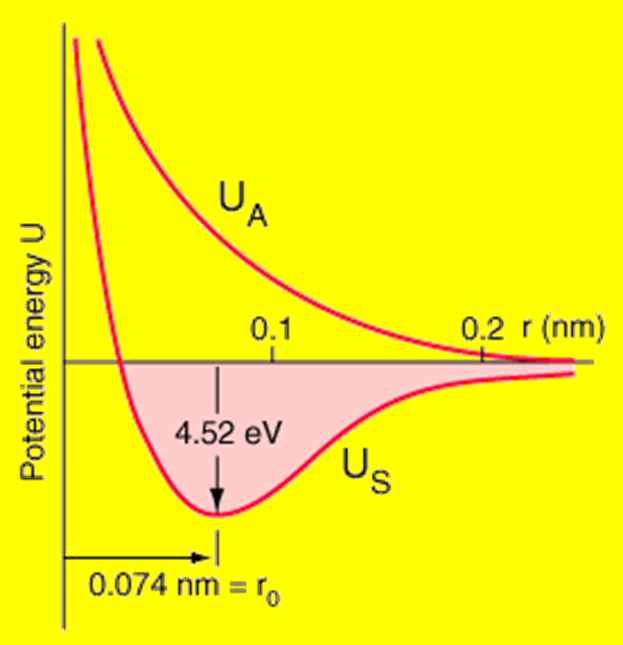
![]() Оценка для двух электронов
дает удвоение энергии связи, т.е. 5,3 эВ по сравнению с 2,65 эВ.
Оценка для двух электронов
дает удвоение энергии связи, т.е. 5,3 эВ по сравнению с 2,65 эВ.
Кулоновское взаимодействие электронов уменьшает энергию связи до 4,52 эВ.

![]() Энергия связи молекулы NaCl
Энергия связи молекулы NaCl
![]() Na + 5,1 эВ
Na + 5,1 эВ ![]() Na+ + е-;
Na+ + е-;
![]() .
.
![]() Чтобы получить два иона Na+ и Cl-,
необходимо затратить энергию 1,5 эВ.
Чтобы получить два иона Na+ и Cl-,
необходимо затратить энергию 1,5 эВ.
Если
эти ионы сблизить, например, на расстояние ~ 4 ![]() , то выделиться
энергия - 3,6 эВ:
, то выделиться
энергия - 3,6 эВ:
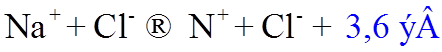 .
.
![]() Отсюда следует, что если переместить электрон из Na к
бесконечно удаленному Cl и позволить образовавшимся ионам сблизиться на
расстояние ~ 4
Отсюда следует, что если переместить электрон из Na к
бесконечно удаленному Cl и позволить образовавшимся ионам сблизиться на
расстояние ~ 4 ![]() ,
то освободиться энергия (3,6 - 1,5) = 2,1 эВ.
,
то освободиться энергия (3,6 - 1,5) = 2,1 эВ.
![]() При дальнейшем
сближении ионов начинают взаимодействовать их электронные
структуры и ядра – возникают силы
отталкивания, т.е. растет потенциальная энергия. Минимум ее
реализуется при R = 2,4
При дальнейшем
сближении ионов начинают взаимодействовать их электронные
структуры и ядра – возникают силы
отталкивания, т.е. растет потенциальная энергия. Минимум ее
реализуется при R = 2,4
![]() (рис.)
и равен U = – 4,2 эВ.
(рис.)
и равен U = – 4,2 эВ.
![]()
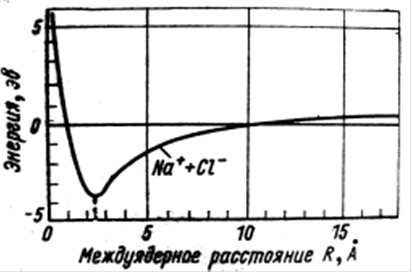
Изменение энергии системы Na+ + Cl– в зависимости от расстояния.
![]() Следовательно, энергия
химической связи молекулы NaCl равна 4,2 эВ.
Следовательно, энергия
химической связи молекулы NaCl равна 4,2 эВ.

(§78, 80, Ландау)
![]() Орбитальный
момент
Орбитальный
момент
![]() В двухатомных молекулах сохраняется только проекция орбитального момента на ось
молекулы.
В двухатомных молекулах сохраняется только проекция орбитального момента на ось
молекулы.
![]()
![]() -
абсолютная величина проекции орбитального момента.
-
абсолютная величина проекции орбитального момента. ![]() 0; 1; 2;...
0; 1; 2;...
|
|
0 |
1 |
2 |
|
терм |
|
|
|
![]() Спин
Спин
![]() Мультиплетность состояния равна 2S + 1.
Мультиплетность состояния равна 2S + 1.
![]()
Термы
![]() Запись терма 2S+1
Запись терма 2S+1![]() .
.
![]() Симметрия
состояний
Симметрия
состояний
![]() Симметрия
относительно плоскости проходящей через ось молекулы- отражение
Симметрия
относительно плоскости проходящей через ось молекулы- отражение
·
Все термы ( кроме ![]() = 0) двукратно вырождены,
отличаясь направлением проекции момента на ось.
= 0) двукратно вырождены,
отличаясь направлением проекции момента на ось.
·
Для ![]() термов
существуют два состояния -
термов
существуют два состояния - ![]() (волновые функции отличаются
знаком).
(волновые функции отличаются
знаком).
![]() Для
гомоядерных молекул –
Для
гомоядерных молекул –
Инверсия
· Четность термов: четные (g) состояния - волновая функция не меняет знак при изменении знака координат электронов, а нечетные (u) - меняет знак.
![]()
![]() Пусть
значения полных орбитальных и спиновых моментов атомов, образующих молекулу
равны: L1, L2 (L1
L2) и
S1, S2.
Пусть
значения полных орбитальных и спиновых моментов атомов, образующих молекулу
равны: L1, L2 (L1
L2) и
S1, S2.
Сохраняется проекция орбитальных моментов на ось ![]() = M1 + M2
и следовательно соответствующая энергия (терм).
= M1 + M2
и следовательно соответствующая энергия (терм).

Определим количество возможных термов двухатомных молекул

Разные атомы (гетероядерные молекулы)
Имеем
1 терм с ![]()
2 терма с ![]()
..................................................
2L2 + 1 термов с ![]()
2L2 + 1 термов с ![]()
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.