Новосибирский Государственный Унивеситет
Факультет Естественных Наук
Кафедра Физической Химии
Лабораторная работа К-32
Определение кинетических параметров ферментативного окисления глюкозы кислородом под действием глюкозооксидазы
Студенты:
Громов Н. В.
Михальченко О.С.
Преподаватель:
Лузгин М.В.
НОВОСИБИРСК
2010 г.
Цель лабораторной работы – определение кинетических параметров реакции окисления глюкозы кислородом, осуществляемой ферментом глюкозооксидазой: константы Михаэлиса KМ и максимальной скорости реакции Wmax.
Краткая теория.
Ферменты, катализаторы многочисленных химических превращений, происходящих в живой клетке, обладают двумя уникальными свойствами: высокой специфичностью по отношению к субстрату и типу реакции и эффективностью катализа, в миллионы раз превышающей эффективность всех известных гомогенных катализаторов химической природы (масштаб ускорений реакции в присутствии ферментов достигает 108-1012 раз).
Глюкозооксидаза (классификационное название фермента - β-D-глюкоза: кислород -оксидоредуктаза) осуществляет реакцию окисления β-D-глюкозы кислородом воздуха при температурах, близких к комнатной:
Фермент имеет четвертичную структуру: состоит либо из 2, либо из 4 субъединиц в зависимости от источника его выделения (бактерии, плесень). Каждая субъединица содержит 1 молекулу кофермента - флавинадениндинуклеотида (ФАД+), непосредственно участвующего в окислительно-восстановительных превращениях субстратов - глюкозы и кислорода.
Ферментативная реакция протекает по механизму "пинг-понга", т. е. стадийно, с последовательным присоединением сначала первого субстрата (глюкозы), затем второго субстрата (кислорода) без образования тройного фермент-субстратного комплекса.
Механизм действия глюкозооксидазы можно изобразить на схеме:
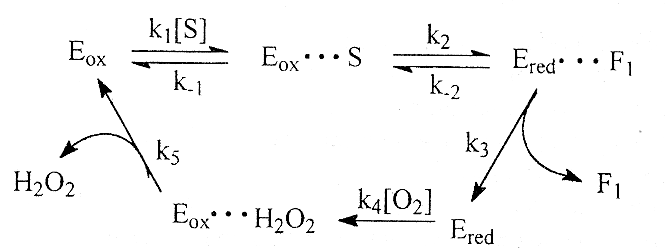
S - глюкоза; F1 - глюконолактон; Еох - окисленная форма фермента; Е геd - восстановленная форма фермента.
Суммарная реакция окисления глюкозы кислородом может быть представлена в виде:
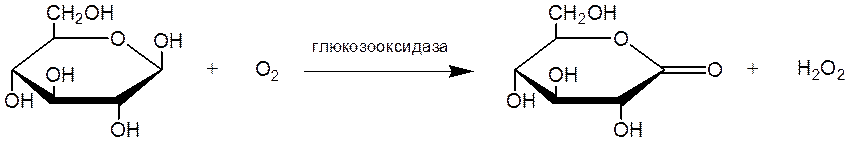
В изученных условиях при постоянной начальной концентрации кислорода в растворе ферментативная реакция протекает по кинетическому закону Михаэлиса-Ментен:
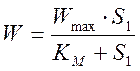
где W - скорость ферментативной реакции, моль/л·с; Wmax - максимальная скорость ферментативной реакции в изученных условиях, моль/л·V·c; Км - константа Михаэлиса, моль/л; S1 - концентрация субстрата глюкозы, моль/л.
Экспериментальная часть.
Необходимые для выполнения работы растворы:
1. 0,05 М калий-фосфатный буфер с рН = 6,0.
1,71 г калия фосфорнокислого однозамещенного растворили в дистиллированной воде в стакане объемом 200 мл. Довели рН полученного раствора до значения 6,0 на рН-метре с помощью раствора едкого натра. Перенесли содержимое стакана в мерную колбу на 250 мл, довели до метки дистиллированной водой.
2. KI-реактив.
0,83 г калия йодистого растворили в 8 мл буферного раствора рН 6,0, добавили 2 мл 9 %-го раствора молибдата натрия, перемешали.
3. 10% раствор β-D-глюкозы
1 гp β-D-глюкозы растворили в 10 мл буферного раствора.
Измерение скоростей ферментативной реакции проводили непосредственно в кювете спектрофотометра. Для этого в кювете смешивали приготовленные заранее реагенты в следующих пропорциях:
|
KI-реактив, мл |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
|
10%-й раствор глюкозы, мкл |
10 |
20 |
50 |
100 |
200 |
400 |
1000 |
|
Буферный раствор, мл |
1,5 |
1,5 |
1,45 |
1,4 |
1,3 |
1,1 |
0,5 |
Реакцию начинали добавлением аликвоты фермента, немедленно интенсивно перемешивали и записывали кинетическую кривую при постоянной длине волны l = 350 нм. Регистрация длилась 1-5 мин в зависимости от количества добавленного фермента. Каждый эксперимент воспроизводили 3 раза.
Из кинетических кривых определили начальную скорость окисления глюкозы, равную скорости выделения перекиси водорода в ферментативной реакции. Концентрацию перекиси водорода определили по реакции с KI-реактивом (Н2О2 + 3I─ + 2Н+→ 2Н2O + I3─), интенсивный максимум поглощения при 350 нм с коэффициентом экстинкции ε = 2,5·104 л/моль·см.
Получили зависимость начальной скорости реакции W0, выраженной в мкмолях, выделившейся перекиси водорода в 1 мин на 1 мкл раствора фермента, от начальной концентрации субстрата в растворе So, моль/л.
|
So, моль/л |
Wo, мкмоль/мин·мкл |
|
0,00276 |
7,2616 |
|
0,00549 |
13,57733 |
|
0,0135 |
27,4554 |
|
0,02775 |
4,480 |
|
0,0555 |
6,608 |
|
0,111 |
10,38457 |
Начиная с концентрации 0,02775 использовали другой раствор глюкозооксидазы, обработку данных при разных растворах глюкозооксидазы провели отдельно.
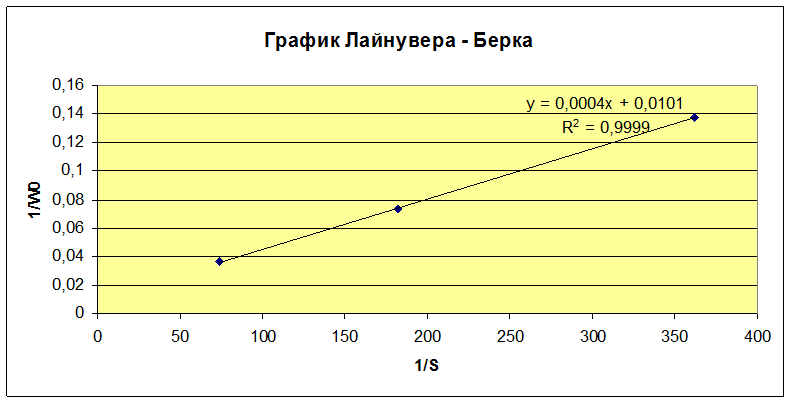
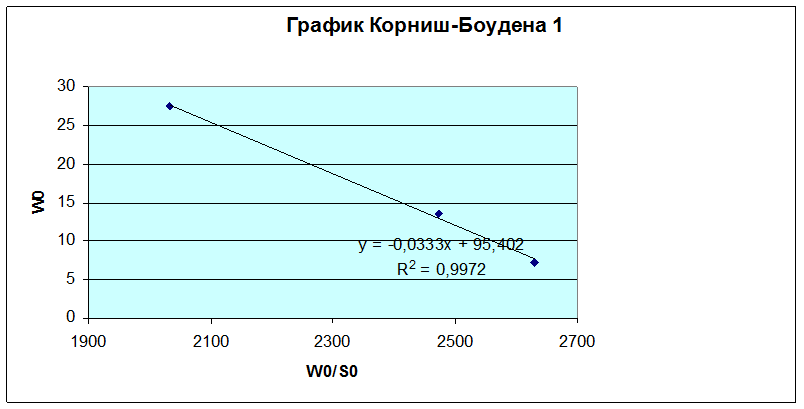
Обработку данных проводили графически в обратных координатах Лайнувера-Берка 1/Wо - 1/So (1), а также Корниш-Боуден Wо - Wо/So (2).
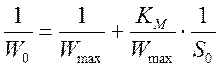 (1)
(1)
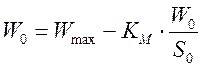 (2)
(2)
Из полученных графиков вычислили константу Михаэлиса по глюкозе Км и максимальную скорость реакции Wmax.
 Для концентраций 0,00276, 0,00549, 0,0135 M.
Для концентраций 0,00276, 0,00549, 0,0135 M.
KM=0,0396 моль/л
Wmax=99 мкмоль/мин·мкл
 Wmax=95,4 мкмоль/мин·мкл
Wmax=95,4 мкмоль/мин·мкл
KM=0,0333 моль/л
Для концентраций 0,02775, 0,0555, 0,111 M (другой раствор глюкозооксидазы).
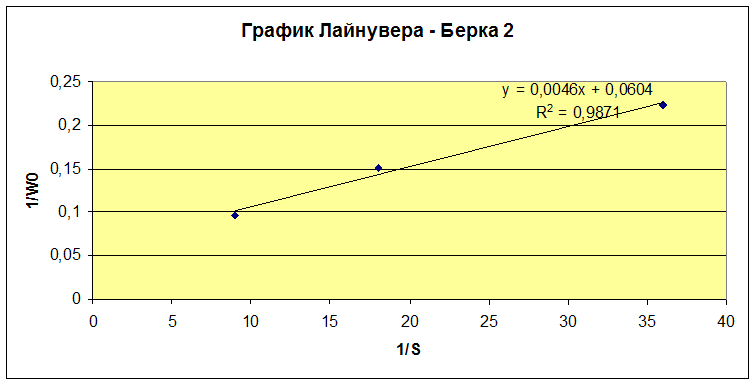
Wmax=16,56 мкмоль/мин·мкл
KM=0,0762 моль/л
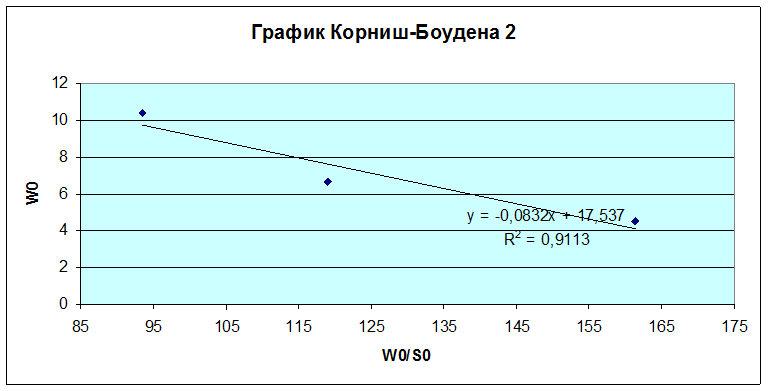
Wmax= 17,537 мкмоль/мин·мкл
KM = 0,0832 моль/л
Выводы
Были определены кинетические параметры реакции окисления глюкозы кислородом спектрофотометрическим методом. Обработка экспериментальных данных проводилась графически в обратных координатах Лайнувера-Берка и Корниш-Боуден. Получены кинетические параметры:
Для певого раствора глюкозооксидазы:
Из графика Лайнувера-Берка KM = 0,0396 моль/л,Wmax = 1,65 моль/л·с
Из графика Корниш-Боудена KM = 0,0333 моль/л,Wmax = 1,59 моль/л·с.
Для второго раствора глюкозооксидазы:
Из графика Лайнувера-Берка KM = 0,0762 моль/л,Wmax = 0,276 моль/л·с
Из графика Корниш-Боудена KM = 0,0832 моль/л,Wmax = 0,292 моль/л·с.
Для отдельных растворов глюкозооксидазы данные согласуются.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.