![]()
Корреляционные диаграммы
· двухатомная молекула образовывается из двух атомов с Z1 и Z2
· продолжая сближать атомы можно получить «объединенный» атом с Z = Z1 + Z2

При таком «объеденении» проекция момента ml электрона должна сохраняться.
![]() На некотором расстояния между
атомами электрическое поле, создаваемое ядрами, можно считать центрально-симметричным с определенными
уровнями энергии.
На некотором расстояния между
атомами электрическое поле, создаваемое ядрами, можно считать центрально-симметричным с определенными
уровнями энергии.
· Между состояниями объединенного и разъединенного атомов должно существовать определенное соответствие (корреляция).
![]() Диаграммы, устанавливающие связь между этими
состояниями, называются корреляционными. При их построении исходят из
следующих положений:
Диаграммы, устанавливающие связь между этими
состояниями, называются корреляционными. При их построении исходят из
следующих положений:
1 - квантовое число ml неизменно;
2 - для гомоядерных молекул сохраняется свойство симметрии;
3 - энергетические уровни с одинаковыми ![]() и симметрией (g, u) не
должны пересекаться. (Л.Л §79)
и симметрией (g, u) не
должны пересекаться. (Л.Л §79)
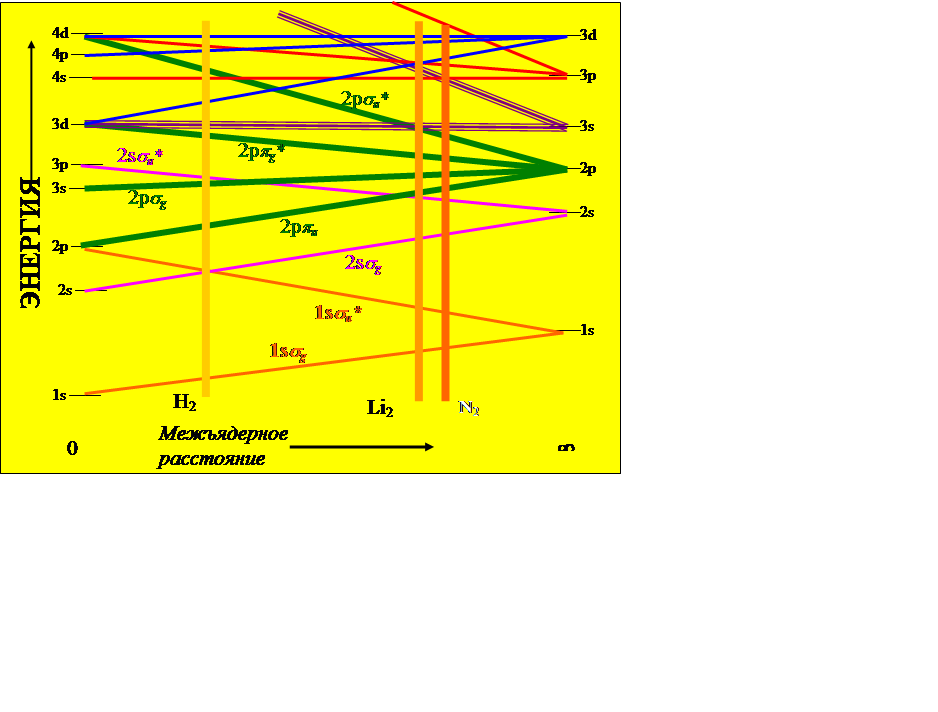
· ![]()
![]() Корреляционная диаграмма для гомоядерных двухатомных
молекул. Отмечены положения H2, Li2 и N2 молекул.
Корреляционная диаграмма для гомоядерных двухатомных
молекул. Отмечены положения H2, Li2 и N2 молекул.
· Видно, что энергия системы уменьшается в случае связывающих орбиталей и возрастает при разрыхляющих
![]() Как видно из диаграммы корреляции,
существуют электроны, переход которых от отдельных атомов к объединенному
сопровождается понижением энергетического уровня, и, наоборот, у других типов
электронов такой переход приводит к повышению энергетического уровня. В первом
случае указанный переход вызывает связывающий эффект, во втором случае - ослабляющий
или разрыхляющий эффект.
Как видно из диаграммы корреляции,
существуют электроны, переход которых от отдельных атомов к объединенному
сопровождается понижением энергетического уровня, и, наоборот, у других типов
электронов такой переход приводит к повышению энергетического уровня. В первом
случае указанный переход вызывает связывающий эффект, во втором случае - ослабляющий
или разрыхляющий эффект.
![]() Рассмотренная картина формирования электронных
состояний молекулы находится в хорошем соответствии с результатами анализа
ковалентной связи простейшей молекулы Н2.
Рассмотренная картина формирования электронных
состояний молекулы находится в хорошем соответствии с результатами анализа
ковалентной связи простейшей молекулы Н2.
При
образовании молекулы из многоэлектронных атомов, например, молекулы С2 мы имеем по два 1s
электрона в каждом томе. По одному из них могут образовать симметричную
молекулярную орбиталь 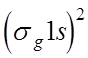 . Однако, два других должны
иметь, согласно принципа Паули, другое состояние, т.е. образуют
антисимметричную разрыхляющую орбиталь
. Однако, два других должны
иметь, согласно принципа Паули, другое состояние, т.е. образуют
антисимметричную разрыхляющую орбиталь 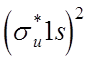 , как
было показано в разделе (2.4).
, как
было показано в разделе (2.4).
![]() Таким образом, все заполненные атомные орбитали при
создании гомоядерных молекул создают равное количество связывающих и разрыхляющих
орбиталей, а реальная связь определяется электронами, у которых не связан спин.
Следовательно, в качестве количественной характеристики способности атомов
создавать реальную связь при образовании молекулы удобно использовать целое
число - удвоенный спин атома. Именно
это число обычно называют валентностью.
Таким образом, все заполненные атомные орбитали при
создании гомоядерных молекул создают равное количество связывающих и разрыхляющих
орбиталей, а реальная связь определяется электронами, у которых не связан спин.
Следовательно, в качестве количественной характеристики способности атомов
создавать реальную связь при образовании молекулы удобно использовать целое
число - удвоенный спин атома. Именно
это число обычно называют валентностью.
![]() Валентность элементов главных групп Периодической
системы.
Валентность элементов главных групп Периодической
системы.
|
Группа |
Типичные элементы |
Электронные состояния |
Cпин |
Валентность |
|
1 |
H |
1s |
1/2 |
1 |
|
Li |
1s22s |
1/2 |
1 |
|
|
2 |
Be |
1s22s2 1s2s12p* |
0 1 |
0 2 |
|
3 |
B |
1s22s22p 1s22s2p2* (B, Al - валентность 3, Tl - валентность 1, 3) |
1/2 3/2 |
1 3 |
|
4 |
С |
1s22s22p2 1s22s2p3* |
1 2 |
2 4 |
|
5 |
N |
1s22s22p3 (NH3) 1s22s12p33s1* (HNO2) |
3/2 5/2 |
3 5 |
|
6 |
O |
1s22s22p4 O2, (H2S) 2p3s1*(SO2) p3s1p1* (SO3) |
1 2 3 |
2 4 6 |
|
7 |
F |
1s22s22p5 F, (HСl) s2p4s1* (HClO2) s2p3s1p1* (HClO3) s2p2s1p2* (HClO4) |
1/2 3/2 5/2 7/2 |
1 3 5 7 |
|
8 |
He |
1s2 |
0 |
0 |
* - возбужденные состояния.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.