Кафедра физической химии
Гомогенный катализ диспропорционирования пероксида водорода аква-ионами Fe2+. Волюмометрический метод.
Определение энергии активации.
Выполнили: А.Е. Арзамасцев
Р.А. Бредихин
Новосибирск, 2006
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
В
лабораторной практике широко известна реакция диспропорционирования пероксида
водорода.![]() (I). Следует
отметить, что подобное превращение протекает довольно легко, что приводит к
ухудшению качества пероксида водорода при стоянии раствора. Кроме того,
диспропорционирование ускоряется под действием излучений или при контакте
раствора с катализаторами, какими могут выступать стекло, уголь, многие
соединения металлов (гетерогенные катализаторы) или растворимые соединения
переходных металлов (гомогенные катализаторы). В данной работе реакция
разложения пероксида водорода ускорялась ионами Fe2+.
(I). Следует
отметить, что подобное превращение протекает довольно легко, что приводит к
ухудшению качества пероксида водорода при стоянии раствора. Кроме того,
диспропорционирование ускоряется под действием излучений или при контакте
раствора с катализаторами, какими могут выступать стекло, уголь, многие
соединения металлов (гетерогенные катализаторы) или растворимые соединения
переходных металлов (гомогенные катализаторы). В данной работе реакция
разложения пероксида водорода ускорялась ионами Fe2+.
Эта система получила название реагента Фентона. Предполагают, что диспропорционирование пероксида водорода протекает по следующей схеме:
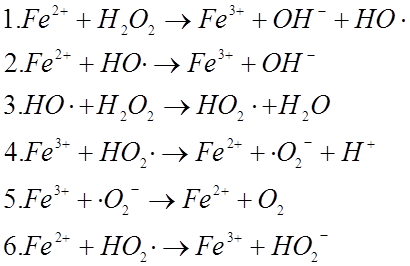
Из
приведённой последовательности стадий можно заключить, что механизм данного
превращения сложен и, по-видимому, включает в себя разное количество стадий в
зависимости от условий проведения эксперимента. Ясно, что механизм может
изменяться при варьировании концентраций реагентов. Действительно, присутствие
катионов железа Fe2+ в концентрации,
превышающей концентрацию пероксида водорода более чем вдвое, приводит только к
окислению ![]() (стадии 1 и 2). Образующийся на стадии 1
гидроксильный радикал имеет два жизненных пути: он либо встречается с ионом Fe2+ (стадия 2), либо взаимодействует со следующей
молекулой пероксида водорода (стадия 3). Вероятность того или иного процесса
определяется концентрацией частиц Fe2+ и H2O2. Поэтому,
в избытке иона металла стадия 3 выражена слабо и её вклад в механизм
незначителен.
(стадии 1 и 2). Образующийся на стадии 1
гидроксильный радикал имеет два жизненных пути: он либо встречается с ионом Fe2+ (стадия 2), либо взаимодействует со следующей
молекулой пероксида водорода (стадия 3). Вероятность того или иного процесса
определяется концентрацией частиц Fe2+ и H2O2. Поэтому,
в избытке иона металла стадия 3 выражена слабо и её вклад в механизм
незначителен.
Считается,
что в диапазоне 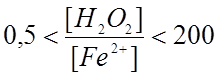 реакция идёт по стадиям 1-6. При
увеличении этого отношения протекают только превращения по стадиям 1, 3-6.
реакция идёт по стадиям 1-6. При
увеличении этого отношения протекают только превращения по стадиям 1, 3-6.
Для осуществления измерений необходимо выбрать удобный метод. Реакцию (I) проводят в водном растворе. Продуктами реакции (I) являются вода и молекулярный кислород. В таких условиях определение количества выделившейся воды оказывается практически невозможным. Поэтому проще использовать для измерения другой продукт реакции – кислород. Можно предложить несколько методов для определения количества выделившегося газа, но их можно разделить на физические и химические.
Примером использования химических свойств является пропускание газа через раствор восстановителя с известной нормальностью и объёмом. После реакции раствор титруется раствором перманганата калия с известной нормальностью. Из закона эквивалентов следует количество кислорода. К сожалению, данный метод громоздок и неудобен. Для определения требуется такой восстановитель, реакция которого с молекулярным кислородом была быстрой, но безопасной. При этом возникают проблемы с приготовлением стандартизацией и хранением реагента, кроме того, необходимо исключить контакт с атмосферным кислородом.
Проще использовать физические свойства кислорода. Так как реакция (I) приводит к образованию газообразного продукта, то важную роль играет давление. По мере протекания реакции на большую глубину возрастает давление кислорода в реакторе, что приводит к уменьшению скорости превращения. Следовательно, система должна иметь сообщение с атмосферой.
Так как измерение давления газа проводить довольно трудоёмко, то можно вместо давления измерять объём выделившегося газа. Для этого предназначен волюмометрический метод. Установка состоит из термостатированного реактора, снабжённого инжектором с резиновой мембраной, краном для соединения с атмосферой и соединения с бюреткой. Реактор помещают на магнитную мешалку, бюретку соединяют с уравнительной склянкой. Через резиновую мембрану в реактор шприцем вносят катализатор, сохраняя систему герметичной. Кран сообщения с атмосферой закрывают и включают секундомер. По мере выделения газа уравнительную склянку опускают. При этом газ собирается в бюретке (т.е. известен объём выделившегося газа), а вода вытесняется в уравнительную склянку.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.