Известно, что
скорость реакции (I) прямо пропорциональна
концентрациям перекиси и ионов железа Fe2+.
Было показано, что скорость реакции перестаёт зависеть от концентрации
пероксида водорода при высоких её значениях, если, кроме того, выполнено
условие 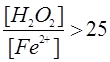 . В этом случае, скорость реакции определяется
только ионами железа, которые находятся в значительном недостатке. Поэтому
концентрация пероксида водорода в ходе превращения может быть принята
постоянной без серьёзной ошибки.
. В этом случае, скорость реакции определяется
только ионами железа, которые находятся в значительном недостатке. Поэтому
концентрация пероксида водорода в ходе превращения может быть принята
постоянной без серьёзной ошибки.
Исследования кинетики реакции в зависимости от кислотности среды показали, что при увеличении pH раствора скорость реакции возрастает. По-видимому, это связано с конкуренцией стадий 4 и 5 механизма. Тем не менее, по мере увеличения pH раствора начинается образование гидроксо-комплексов Fe3+ (pH>3,5). Данный факт приводит к переходу от гомогенного катализа к гетерогенному, поэтому скорость превращения снижается.
Непосредственной целью нашей работы было определение энергии активации реакции (I). Из теории известно, что константа скорости реакции зависит от температуры. В первом приближении эта зависимость может быть описана уравнением Аррениуса:
(1)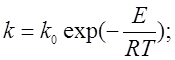
Записывая уравнение (1) считают, что предэкспоненциальный множитель k0 и энергия активации E не зависят от температуры. Такое приближение вполне оправдано в условиях опыта, так как температуры, при которых осуществляют измерения несильно отличаются от комнатной.
Для расчёта энергии активации нами был проведён опыт при трёх разных температурах. Начальные концентрации компонентов раствора сохраняли без изменений.
Из предположения, что при концентрации пероксида водорода 0,250 моль/л и концентрации ионов железа Fe2+ 0,0125 моль/л, реакция (I) имеет первый порядок по пероксиду водорода, можно получить следующее выражение для скорости реакции: (2)
|
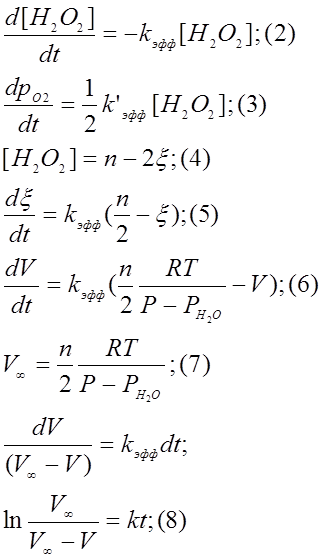
После этого по методу наименьших квадратов можно определить эффективную константу скорости реакции из уравнения (8). Если провести расчёт для нескольких температур, то подстановка значений температуры и эффективной константы скорости реакции в уравнение (1) дают систему уравнений относительно E и k0.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. Раствор пероксида водорода.
В мерную колбу на 200мл мерным цилиндром поместили ≈30мл водного раствора пероксида водорода. Раствор довели до метки дистиллированной водой.
В конические колбы на 100мл отобрали аликвоты раствора объёмом 1мл, добавили мерным цилиндром 25мл 0,6N серной кислоты для создания кислой среды. Полученные растворы оттитровали 0,2000N раствором перманганата калия.
![]()
Получены следующие объёмы титранта, затраченного на окисление пероксида водорода: 10,50мл, 10,52мл, 10,55мл, 10,58мл. Из закона эквивалентов получаем нормальность раствора пероксида водорода. 2,1075 N, т.е. концентрация раствора C1=1,0538моль/л.
2. Раствор соли Мора.
Молярная масса соли Мора (NH4)2FeSO4*6H2O составляет 392 г/моль. Для приготовления 100мл 0,25М раствора Fe2+ требуется 0,25*392*0,1=9,8г соли Мора. На электронных весах взвешено 9,802г соли, навеска количественно перенесена в мерную колбу на 100мл. Для предотвращения гидролиза ионов железа и защиты от окисления кислородом воздуха приготовили раствор соли Мора не в дистиллированной воде, а в 0,2000N серной кислоте. Довели до метки раствором кислоты.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.