Кафедра физической химии
Изучение кинетики реакции йодирования ацетона спектрофотометрическим методом.
Выполнили: А.Е. Арзамасцев
Р.А. Бредихин
Новосибирск, 2006
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Карбонильные соединения, содержащие связь углерод-водород по соседству с карбонильной группой проявляют в реакциях свойство β C–H кислотности, которое выражено значительно сильнее, чем у спиртов. В результате реализуется кето-енольная таутомерия, которая происходит с карбонильным соединением и в кислой, и в основной среде. Основание или кислота являются необходимыми катализаторами такого превращения. Без катализатора превращение кетона или альдегида в енол не реализуется.
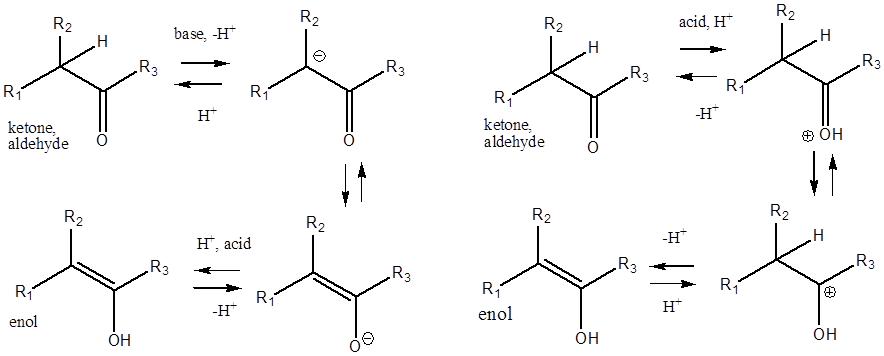
Как правило, карбонильное соединение существует в
виде смеси обеих форм, хотя содержание енола обычно очень мало – на уровне 10-6-10-4.
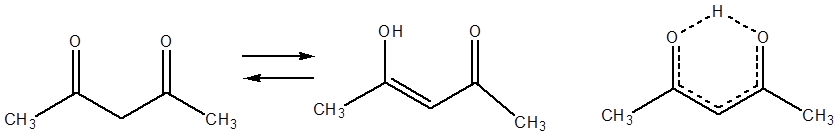
Исключением являются случаи, когда существует дополнительная стабилизация
енольной формы. Так, в ацетилацетоне содержание кето-формы составляет всего 20%
за счёт возникающего в ходе енолизации A p-![]() сопряжения B.
сопряжения B.
|
|
Многие реакции карбонильных соединений протекают через промежуточное образование енола. Видимо, это связано с тем, что более эффективно проводить реакцию в две стадии, на каждой из которых энергетический барьер не очень велик, чем осуществлять превращение в одну стадию, но с очень высокой энергией активации.
В данной работе нами изучалась кинетика реакции йодирования ацетона. Суммарное уравнение имеет вид:
![]() (I)
(I)
В действительности данное превращение осуществляется по стадиям:
|
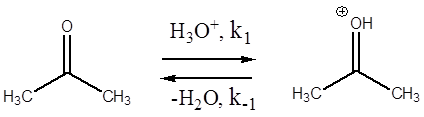
|
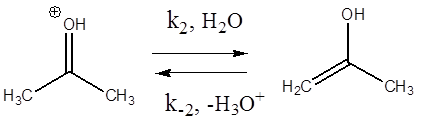
|
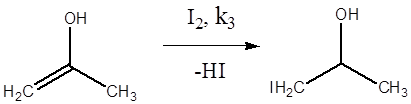
Первые две стадии отображают процесс кето-енольной таутомерии, протекающей под действием кислоты как катализатора. Третья стадия – образование йодацетона. Подобные реакции известны и для других галогенов (хлор, бром).
Реакцию проводят в кислой среде, хотя основание тоже делает возможным подобное превращение. Причина заключается в том, что основание на первой стадии отрывает протон. Поэтому, сравнивая исходный ацетон и вновь образующийся йодацетон, мы видим, что протон метиленовой группы продукта (йодацетона) оказывается более кислым, чем протон метильной группы реагента (ацетона). Дальнейшее превращение по аналогичному механизму, но с большей скоростью, происходит с галогенацетоном. В результате образуется дигалогенацетон, содержащий ещё более кислый протон и т.д.
|
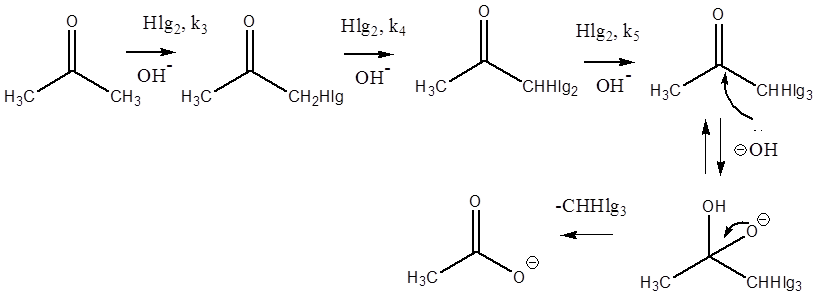
Таким образом, изучать кинетику реакции йодирования ацетона необходимо именно в кислой среде, когда первой стадией является протонирование атома кислорода карбонильной группы.
Нахождение истинной константы скорости реакции йодирования ацетона и константы равновесия протонирования ацетона
Введём некоторые обозначения для упрощения записи. CA – аналитическая концентрация ацетона; [A]
– равновесная концентрация ацетона; [HA] – равновесная концентрация
протонированной формы ацетона, k2 – константа скорости второй стадии реакции (I).
Тогда величина 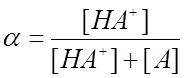 (1) будет описывать долю
протонированной формы ацетона в растворе.
(1) будет описывать долю
протонированной формы ацетона в растворе.
Лимитирующей стадией процесса, по литературным
данным, является вторая стадия – енолизация протонированной молекулы ацетона
[1]. Поэтому скорость химической реакции (I) может быть представлена как
скорость второй стадии (I.II) как самой медленной: ![]() .
.
Ясно, что для анализируемого раствора величина α
сохраняется постоянной и может быть включена в константу скорости реакции.
Полученная величина называется эффективной константой скорости реакции. ![]() .
.
Константа равновесия реакции (I.I) представляет
собой константу равновесия реакции протонирования ацетона, её выражение запишем
так: 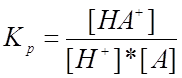 (2).
(2).
Проведём некоторые математические преобразования:
|
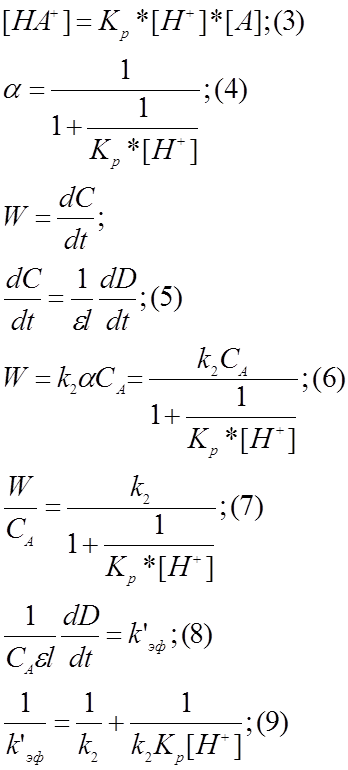
Для изучения кинетики реакции (I) был использован спектрофотометрический метод. Целесообразность такого выбора следует из того, что в реакции участвует I2, который поглощает в видимой области. Так как в ходе реакции йод расходуется, то мы должны получить график убывания оптической плотности раствора с течением времени.
Из приведённых вычислений следует, что необходимо провести калибровку для определения молярного коэффициента экстинкции для молекулы I2 на некоторой подходящей длине волны. После этого, следует приготовить серию растворов с разной кислотностью, но одинаковой концентрацией йода. Кроме того, работать следует с каждым раствором поочерёдно, чтобы промежуток времени между приготовлением раствора с ацетоном и выполнением измерения оптической плотности был минимален.
Вычисление
эффективной константы легко провести из равенства (8). Полученные значения,
подставленные в (9) позволяют получить набор точек ([H+],
k’эф).
По методу наименьших квадратов легко рассчитать коэффициент пропорциональности 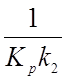 . Значение
. Значение ![]() соответствует
свободному члену, следовательно, константа равновесия реакции протонирования
ацетона равна отношению свободного члена к коэффициенту пропорциональности в
уравнении (9).
соответствует
свободному члену, следовательно, константа равновесия реакции протонирования
ацетона равна отношению свободного члена к коэффициенту пропорциональности в
уравнении (9).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.