НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКУЛЬТЕТ ЕСТЕСТВЕННЫХ НАУК
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ
Курсовая работа
ИЗУЧЕНИЕ КИНЕТИКИ РЕАКЦИИ
САЛИЦИЛОВОГО АЛЬДЕГИДА С АНИЛИНОМ
МЕТОДОМ ЯМР
Студенты:
Быков М. М.
Шабалин А.Ю
Преподаватель:
д. х.н. Талзи Евгений Павлович
НОВОСИБИРСК 2008 г.
1. Введение
Реакции альдегидов и кетонов с первичными и вторичными аминами являются классическим примером нуклеофильного присоединения по карбонильной группе. Конечными продуктами реакции в случае первичных аминов являются имины (основания Шиффа). Реакции такого типа находят применение в различных областях химической промышленности. Один из самых ярких примеров – синтез хинолина по Фридлендеру (ур.1):
|
|
(1) |
Поэтому является необходимым детально изучить кинетические особенности реакций нуклеофильного присоединения для усовершенствования и оптимизации условий проведения процессов. В настоящей работе проводилось исследование кинетических особенностей реакции анилина и салицилового альдегида (ур.2)
|
|
(2) |
Эта реакция представляет особенный интерес, поскольку именно анилин ускоряет образование иминов в мягких условиях, открывая возможности более широкого использования реакций иминирования и переиминирования в синтетической химии. Профессор Филипп Доусон и его соавторы сообщают, что анилин является эффективным катализатором реакций альдегидов и кетонов с аминами, гидразинами, протекающих с образованием иминов (RR'C=NR''), гидразонов (RR'C=NNR'') соответственно. Исследователи сообщают также и о том, что анилин катализирует реакции переиминирования.
Доусон пишет, что выполняющий функцию нуклеофильного катализатора анилин проявляет высокую активность практически во всех системах, опробованных учеными. Так, например, в водном растворе в интервале pH от 4 до 7 анилин ускоряет как иминирование, так и переиминирование в несколько раз. Способность катализатора работать в воде при нейтральной или слабокислой реакции оказывается особенно важным для применения в биомолекулярных и цитологических технологиях. Имины представляют собой один из наиболее изучаемых классов органических соединений в рамках синтетической химии.
На настоящий момент анилин является единственным соединением, проявляющим каталитические свойства в реакциях образования иминов и переиминирования, протекающих в водной среде. Руководитель исследовательской группы также ожидает проявления анилином каталитических средств и в неводных средах. Профессор химии Стефан Кент отмечает высокую значимость обнаруженного каталитического эффекта, проявляемого анилином, для оксимной модификации пептидов, протекающего, как правило, с невысокой скоростью.
Кент отмечает, что «Возможность использовать анилин и осуществить в течение нескольких часов превращения, обычно протекающие в течение нескольких дней, открывает широкие перспективы во многих областях биохимии. Например, катализируемая анилином оксимная модификация белков может оказаться весьма полезным для синтеза многих лекарств, например эритропоэтина». Целью нашей работы явилось изучение кинетики реакции в четыреххлористом углероде, выявление каталитических особенностей анилина в неводных средах, а также выявления температурной зависимости скорости реакции и определение энергии активации.
Стандартный механизм реакции нуклеофильного присоединения представлен на схеме 1.
|
|
|
Схема 1 |
Таким образом, если анилин в данной реакции выступает только в качестве нуклеофила, то ожидаемый порядок реакции должен быть близок к единице. Если же анилин проявляет каталитические свойства, как это было предсказано Филиппом Доусоном, то мы можем ожидать существенного изменения порядка реакции.
2. Экспериментальная часть
В настоящей работе кинетика реакции изучалась при помощи метода ядерного магнитного резонанса (1Н), который является наиболее подходящим экспрессным методом для исследования данной реакции. Измерения проводились на ЯМР Фурье-спектрометре Bruker DPX-250 со сверхпроводящим магнитом (рабочая частота 250 MHz).
Сразу после добавления анилина к раствору салицилового альдегида в CCl4 в спектре ПМР сигнал ОН-протона исчезает вследствие уширения линии, вызванного химическим обменом с NН2-протонами анилина, сигнал СН-протона альдегида постепенно уменьшается и растет сигнал СН-протона основания Шиффа. Константу скорости реакции можно измерить из графической зависимости:
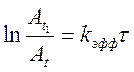
Где ![]() - интенсивность сигнала СН-салицилового
альдегида в момент времени t1, принимаемый за начальный,
- интенсивность сигнала СН-салицилового
альдегида в момент времени t1, принимаемый за начальный, ![]() - интенсивность этого сигнала в момент
времени t,
- интенсивность этого сигнала в момент
времени t, ![]() . Для устранения влияния возможного
изменения условий записи спектра вместо
. Для устранения влияния возможного
изменения условий записи спектра вместо![]() использовали
использовали
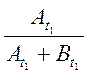 , а вместо
, а вместо ![]() -
- 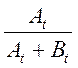
где ![]() ,
, ![]() – интенсивности
сигнала СН-протона основания Шиффа в моменты времени t1 и t
соответственно.
– интенсивности
сигнала СН-протона основания Шиффа в моменты времени t1 и t
соответственно.
Чтобы оценить энергию активации реакции, провели определение kэфф при трех температурах 20, 40 и 50 оС. В ампуле приготовили растворы содержащие 1,0 моль/л РhNН2, 0,1 моль/л салицилового альдегида в CCl4. Для каждой температуры спектры записывали с соответствующим интервалом времени.
|
Т, K |
Интервал,c |
|
Т, K |
Интервал,c |
|
Т, K |
Интервал,с |
|
|
298 |
352 |
7,6*10-5 |
313 |
112 |
1,6ּ10-3 |
323 |
112 |
7,3*10-4 |
|
At |
Bt |
Kэфф, с-1 |
At |
Bt |
Kэфф, с-1 |
At |
Bt |
Kэфф, с-1 |
|
1 |
0,1022 |
7,6ּ10-5 |
1 |
0,51 |
1,4ּ10-3 |
1 |
0,0552 |
4.5ּ10-4 |
|
1 |
0,1322 |
8,0ּ10-5 |
1 |
0,7584 |
1,5ּ10-3 |
1 |
0,1097 |
5.9ּ10-4 |
|
1 |
0,1646 |
7,7ּ10-5 |
1 |
1,0891 |
1,6ּ10-3 |
1 |
0,1853 |
8.6ּ10-4 |
|
1 |
0,1964 |
7,1ּ10-5 |
1 |
1,5072 |
1,7ּ10-3 |
1 |
0,3056 |
1.0ּ10-3 |
|
1 |
0,2266 |
1 |
2,0312 |
1 |
0,4642 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.