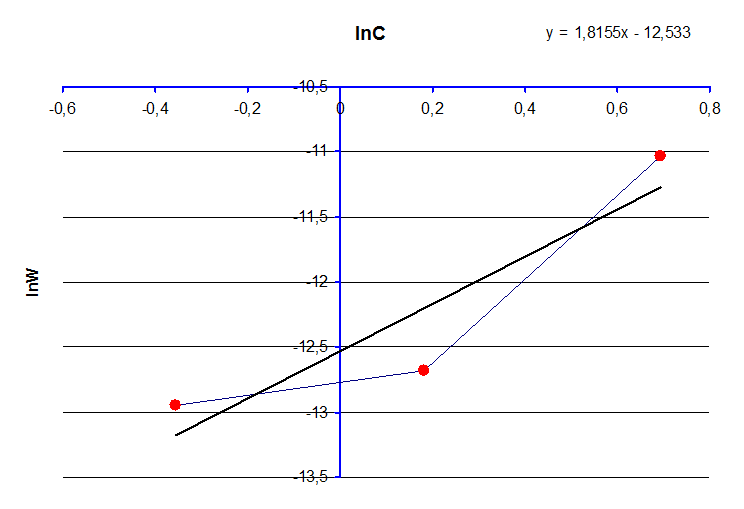
Исходя из экспериментальных данных построили график зависимости в координатах lnkэфф – 1/T.
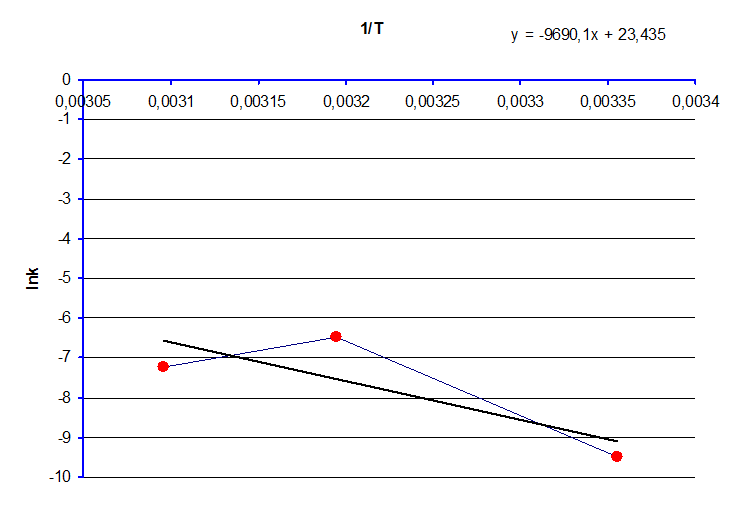
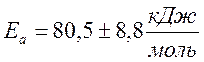
Чтобы оценить энергию порядок реакции по анилину, провели определение kэфф при трех различных концентрациях анилина 0,7; 1,2; 2,0 M при 25 оС, концентрация салицилового альдегида была постоянной - 0,1 М. В ампулах приготовили соответствующие растворы в CCl4. Для каждой концентрации спектры записывали с соответствующим интервалом времени.
|
С,M |
Интервал,c |
|
С,M |
Интервал,c |
|
С,M |
Интервал,с |
|
|
0,7 |
652 |
3,4*10-5 |
1,2 |
232 |
2,6*10-5 |
2,0 |
232 |
8,1*10-5 |
|
At |
Bt |
Kэфф, с-1 |
At |
Bt |
Kэфф, с-1 |
At |
Bt |
Kэфф, с-1 |
|
1 |
0,4543 |
3,4ּ10-5 |
1 |
0,0048 |
3,5ּ10-5 |
1 |
0,0165 |
1,1ּ10-4 |
|
1 |
0,4873 |
3,8ּ10-5 |
1 |
0,013 |
3,1ּ10-5 |
1 |
0,0432 |
7,9ּ10-5 |
|
1 |
0,5242 |
3,1ּ10-5 |
1 |
0,204 |
8,5ּ10-7 |
1 |
0,0625 |
4,5ּ10-5 |
|
1 |
0,5549 |
3,3ּ10-5 |
1 |
0,207 |
3,7ּ10-5 |
1 |
0,0736 |
8,8ּ10-5 |
|
1 |
0,5891 |
1 |
0,0293 |
1 |
0,0959 |
Исходя из экспериментальных данных построили график зависимости в координатах lnW – lnC.
![]()
3.Обсуждение результатов
Проведенные эксперименты показали, что порядок реакции по анилину близок к двум, что доказывает участие анилина в катализе данной реакции. Можно предположить, что вторая молекула анилина участвует в протонировании промежуточного карбиноламина, т.е. фактически для протекания одной реакции необходимо присутствие двух молекул анилина рядом с молекулой салицилового альдегида, одна из которых непосредственно реагирует с альдегидом, а другая служит переносчиком протона.
|
|
(3) |
Следует отметить, что равновесие такой реакции существенно сдвинуто в сторону реагентов, поэтому в системе присутствуют сравнительно небольшие количества протонированного анилина.
Тогда схему реакции можно упрощенно представить следующим образом:
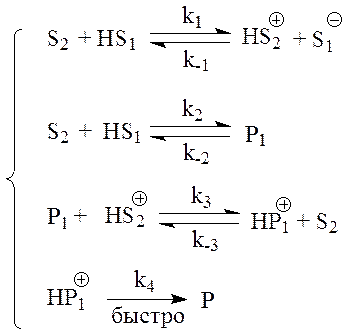
Здесь HS1 – салициловый альдегид , S2 – анилин, P1 – карбиноламин, P – конечный продукт.
В этом случае, исходя из предположения о равновесности первой и второй стадии и быстроте превращения протонированного карбиноламина в конечный продукт, скорость реакции описывается выражением:
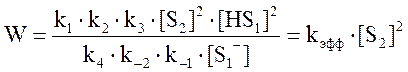
Таким образом, получаем модель согласующуюся с экспериментом, причем, возможно, отклонение порядка реакции от точного значения 2 связано с небольшим изменением kэфф при изменении концентрации анилина в системе.
Другим объяснением наблюдаемого порядка реакции может являться так называемый концертный механизм передачи протона, который также требует двух молекул анилина (ур.4)
|
|
(4) |
В этом случае кинетическую схему можно упрощенно представить следующим образом:
![]()
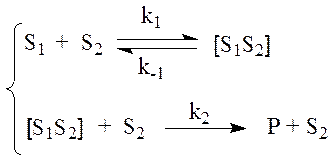
Где S1 – салициловый альдегид, S2 – анилин, [S1S2] – комплекс, строение которого указано в уравнении 4. В предположении равновесности первой стадии скорость образования продукта P можно записать следующим образом:
|
W = kэфф[S1][S2]2 |
(5) |
где kэфф=k1k2/k-1
Такая модель также согласуется с полученными экспериментальными данными.
Важным фактом подтверждающим концертный механизм является изменение порядка реакции по анилину от двух до единицы при добавлении в систему небольших количеств этилового спирта. Атом кислорода в этиловом спирте обладает большей электроотрицательностью по сравнению с атомом азота в анилине, что обеспечивает больший положительный заряд на атоме водорода, который, в свою очередь лучше связывается с кислородом альдегида. Таким образом, этиловый спирт может выполнять каталитические функции анилина (ур.6)
|
|
(6) |
В настоящее время достоверный механизм катализа полностью не установлен, но все большее количество публикаций по данной теме свидетельствует о том, что скоро истинный механизм будет найден.
4.Выводы
Результатом работы стало экспериментальное определение энергии активации реакции нуклеофильного присоединения анилина к салициловому альдегиду, а также определение порядка реакции по анилину. Полученные данные подтверждают каталитические свойства анилина в реакциях такого типа, что согласуется с предположениями ученых, занимающихся исследованием механизмов в водных средах.
5.Список использованной литературы
[1] Марч Дж. Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4-х т. Т.3. Пер. с англ.- М.:Мир, 1987.- 459 с., ил.
[2] Органическая химия: в 4-х частях. Ч.3: Учеб. Для вузов, обучающихся по направлению и специальности «Химия» / О.А. Реутов, А.Л. Курц, К.П. Бутин _ М.: Бином. Лаборатория знаний, 2004. – 544 с.
[3] Замараев К.И. Химическая кинетика: Курс лекций: В 3.ч. / Под ред. А.Г. Окунева, К.П. Брылякова; Новосиб. гос. ун-т. Новосибирск, 2004. Ч 3. 106 сc.
[4] В. А. Рогов, Г. А. Коваленко, Е. П. Талзи. Практикум по физической химии. Новосибирск: НГУ, 2007
[5] Ресурсы сайта http://chemistry.user.kz
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.