4. O2* (O2*). Возбужденная молекула кислорода.
5. O2+ (O2+). Ионизованная молекула кислорода. Задана подвижность.
6. O- (O-). Отрицательный ион атомарного кислорода. Он образуется в результате «прилипания» электрона к атомарному кислороду.
7. O2- (O2-). Отрицательный ион молекулярного кислорода. Образуется в результате прилипания электрона к молекулярному кислороду.
В объеме заданы следующие реакции.
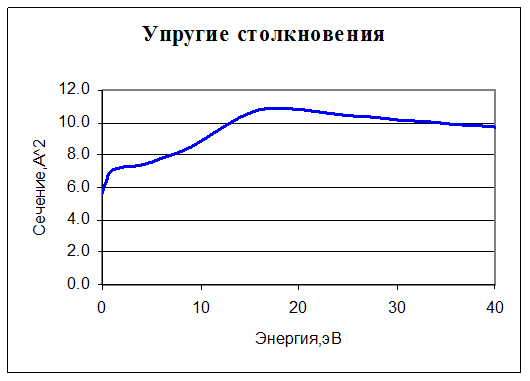
1. O2 + e -> O2 + e. Упругое столкновение. Учитываются только столкновения с молекулами нейтрального кислорода, поскольку их концентрация на много порядков больше, чем всех остальных молекул. Для нее задано сечение реакции:
2. O2 + e -> O2+ + 2e. Ионизация. Для нее также задано сечение реакции:
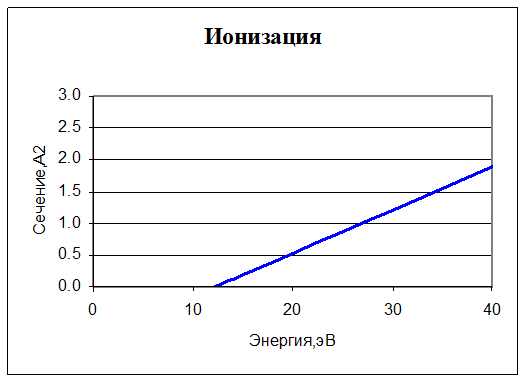
В интересующем нас диапазоне энергий сечение ведет себя практически линейно. Порог ионизации у O2 – 12,2 эВ, при энергии меньше этой величины сечение равно нулю.
3. O2+ + e -> O + O. Рекомбинация (диссоциативная). Скорость реакции существенно зависит от температуры электрона. С ее ростом скорость падает, сначала пропорционально Te-1/2, затем пропорционально Te-3/2. В интересующем нас диапазоне энергий 0,1-10 эВ график хорошо аппроксимируется степенной зависимостью вида: ω=βTemn[O2]n[e], где m = -0,673, а β = 2,338∙10-7.
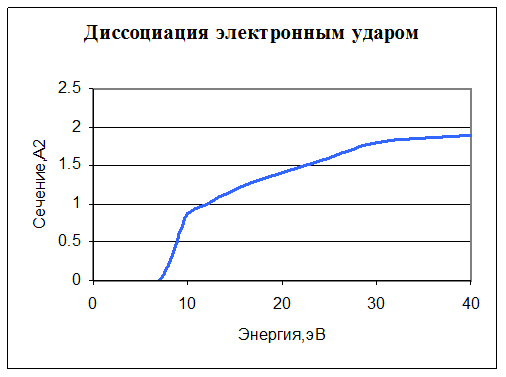
4. e + O2 -> e + O + O. Диссоциация. Задано сечение реакции:
5. O- + O2+ -> O + O2. Ион-ионная рекомбинация. Реакция описывается простым соотношением: ω=βn[O-]n[O2+], где β=10-7 см3/с, или, в единицах, используемых в CFD-ACE, β=6∙1013 м3/кмоль∙с.
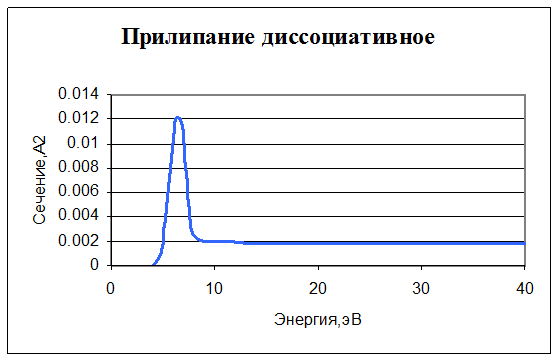
6. e + O2 -> O + O-. Прилипание (диссоциативное). Задано сечение реакции, порог – 3,6 эВ.
7. O + O- -> O2 + e. Отсоединение электрона. Реакция описывается простым соотношением: ω=βn[O]n[O-], где β=2∙10-10 см3/с, или, в единицах, используемых в CFD-ACE, β=1,2∙1011 м3/кмоль∙с.
8. e + O2 -> e + O2*. Возбуждение. Задано сечение реакции и уход энергии из системы (из-за излучения) – 1,64 эВ.
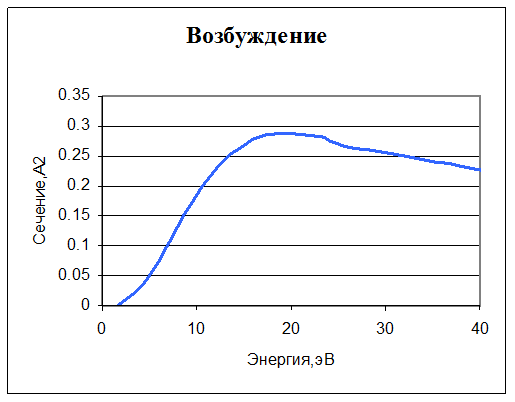
9. O- + O2* -> e + O + O2. Отсоединение электрона. Реакция описывается простым соотношением: ω=βn[O-]n[O2*], где β=3∙10-10 см3/с, или, в единицах, используемых в CFD-ACE, β=1,8300∙1011 м3/кмоль∙с.
10. e + O2 + O2 -> O2- + O2. Прилипание в тройном столкновении. При низких температурах (до 2 эВ) эта реакция является основным каналом прилипания. Реакция описывается соотношением ω=βn[e](n[O2])2. Здесь β = 1,4∙10-43 м6/с, или, в единицах, используемых в CFD-ACE, β=8,7∙10-17 м6/(кмоль∙с). При нормальных условиях эта константа соответствует частоте прилипания ν=0,9∙10-8 с-1.
11. O2- + O2 -> 2O2 + e. Отлипание. Реакция описывается соотношением ω=βn[O2-]n[O2]. Здесь β = 2,2∙10-24 м3/с, или, в единицах, используемых в CFD-ACE, β=1,33∙103 м3/(кмоль∙с).
12. O2- + O2* -> 2O2 + e. Отлипание. Реакция описывается соотношением ω=βn[O2-]n[O2*]. Здесь β = 2∙10-16 м3/с, или, в единицах, используемых в CFD-ACE, β=1,2∙1011 м3/(кмоль∙с).
На текущий момент сошедшегося стационарного решения нет, однако решение меняется медленно. Рассмотрим решение в один из моментов времени, напряжение 3 кВ.
Электроны присутствуют на расстоянии до 500 мкм от катода.
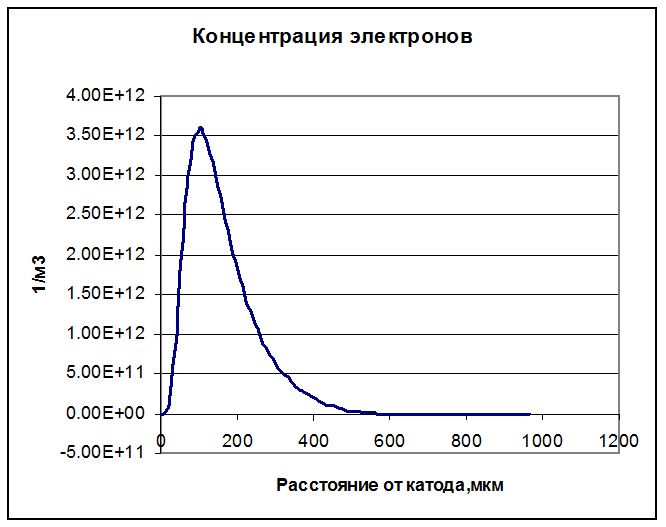
Рисунок 36. Концентрация электронов.
Как и в азоте, температура электронов значительно падает с расстоянием, как и напряженность поля.
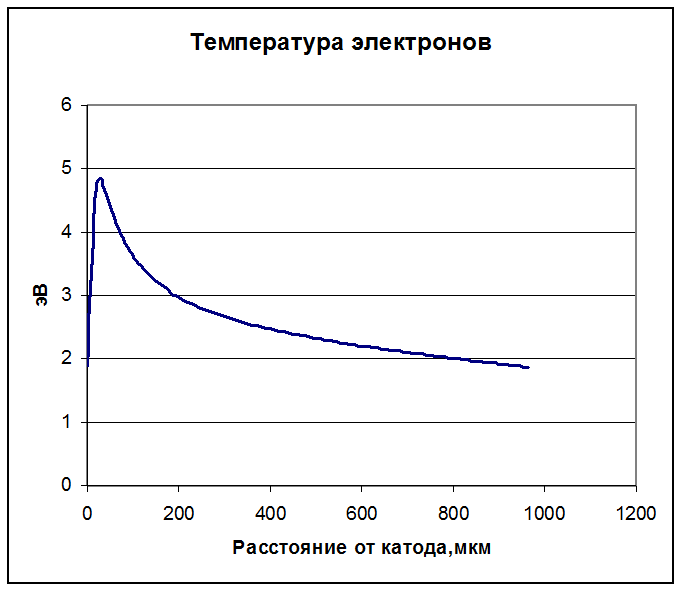
Рисунок 34. Температура электронов.
Положительные ионы присутствуют в узкой области рядом с катодом – на расстоянии до 200 мкм. Далее пространство заполнено отрицательными ионами, причем, преимущественно атомарными.
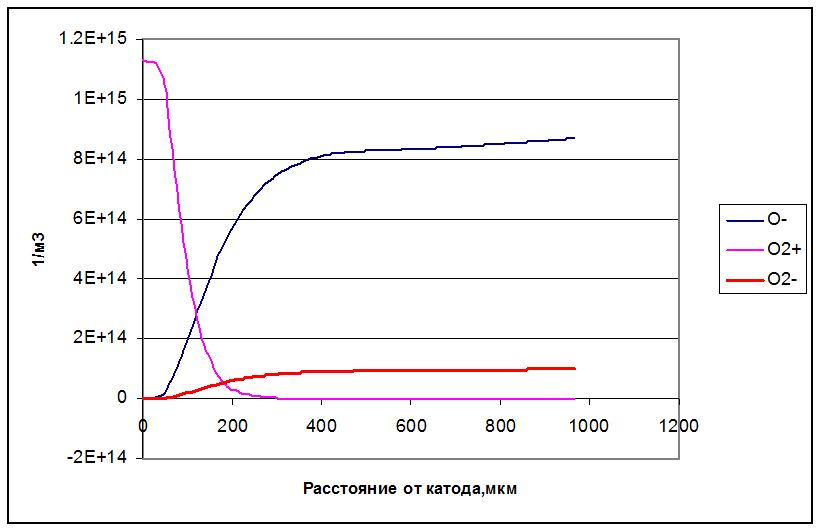
Рисунок 35. Концентрация ионов.
До 100 мкм ток определяется положительными ионами, затем развивается лавина - значителен электронный ток, а затем электроны прилипают к молекулам кислорода, и ток снова ионный.
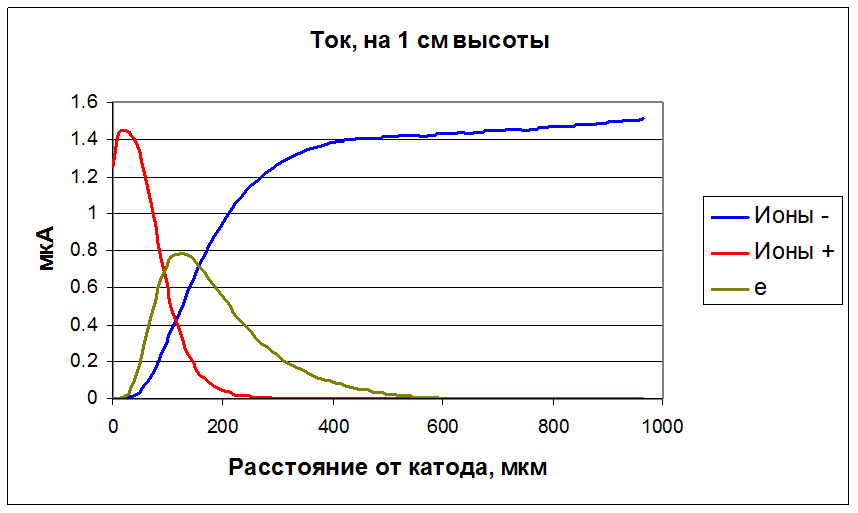
Рисунок 33. Электронный и ионный ток. В расчете на 1 см высоты модели.
Концентрация электронов на 2 порядка меньше концентраций ионов, однако обеспечивает сравнимый ток, поскольку скорость электронов гораздо выше.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.