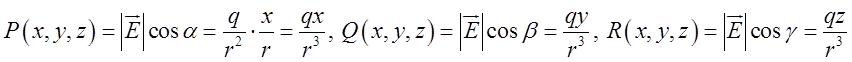 . Поле описується такою вектор-функцією
. Поле описується такою вектор-функцією 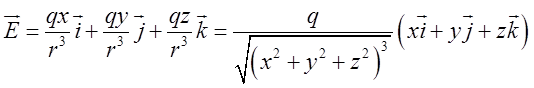 . Перевіримо потенціальність, тобто
виконання рівностей
. Перевіримо потенціальність, тобто
виконання рівностей 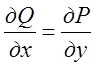 ,
,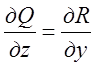 ,
,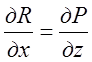 , враховуючи, що
, враховуючи, що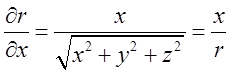 ;
; 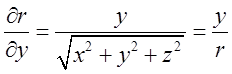 ;
;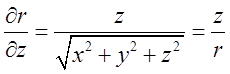 .
.
Тоді 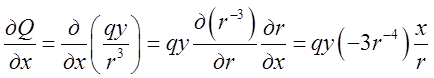 , аналогічно
, аналогічно 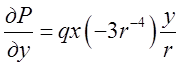
і, як бачимо, 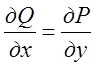 . Інші дві рівності також виконуються – перевірте самостійно. Поле
потенціальне. Робота не залежить від форми шляху інтегрування.
. Інші дві рівності також виконуються – перевірте самостійно. Поле
потенціальне. Робота не залежить від форми шляху інтегрування.  =
=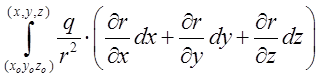 =
=
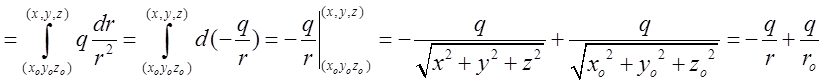 . (9.2) Так, як величина
. (9.2) Так, як величина ![]() є величина постійна, то потенціалом поля
є функція
є величина постійна, то потенціалом поля
є функція 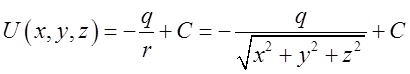 (9.3)
(9.3)
Тому, що заряди
однойменні, то робота позитивна при їхньому віддаленні друг від друга ![]() і негативна при їхньому зближенні
і негативна при їхньому зближенні ![]() .
.
9.3. Задача про виділення тепла ідеальним газом. Ентропія
Перш ніж поставити
задачу визначимось з термінологією та поняттями, які застосовуються в
термодінаміці. Будемо під станом речовини розуміти сукупність величин,
що характеризують її фізичний стан. У термодинаміці звичайно цими величинами служать: тиск
– р, об’єм – v і абсолютна температура – Т. Отже, стан визначається трьома величинами: р, v, Т. Але вони зв'язані між собою
одним рівнянням – так званим рівнянням
стану![]() . Тому стан
фактично визначається двома величинами, наприклад р i v (третя, Т, є функція р i v). При подальшому
досліджені виділення тепла, за осі
системи координат ми візьмемо р і v. Геометрично кожному стану відповідає
точка М (р,v) у площині РOV, а кожному процесу ( що складається в послідовній
зміні стану тіла) – лінія. Вона називається діаграмою процесу. У тому
випадку, коли відбувається повернення до вихідного стану, процес називають круговим
чи циклічним; (згадайте зі
школи – цикл Карно) його діаграмою будe замкнута
линия.
. Тому стан
фактично визначається двома величинами, наприклад р i v (третя, Т, є функція р i v). При подальшому
досліджені виділення тепла, за осі
системи координат ми візьмемо р і v. Геометрично кожному стану відповідає
точка М (р,v) у площині РOV, а кожному процесу ( що складається в послідовній
зміні стану тіла) – лінія. Вона називається діаграмою процесу. У тому
випадку, коли відбувається повернення до вихідного стану, процес називають круговим
чи циклічним; (згадайте зі
школи – цикл Карно) його діаграмою будe замкнута
линия.
Нехай маємо
ідеальний газ, тобто газ, в якому виконується рівняння стану Менделеєва – Клапейрона ![]() , де R універсальна газова постійна величина.
, де R універсальна газова постійна величина.
Поставимо перед собою задачу – знайти
кількість тепла Q, поглиненого (чи виділеного) газом
при процесі, зображеному даною діаграмою L. На кривій циклу L виділимо довільну її
ділянку від точки М(р,v)
до точки ![]() і
розглянемо «нескінченно малий» процес. Кількість тепла,
яка виділиться під час цього процесу, позначимо через
і
розглянемо «нескінченно малий» процес. Кількість тепла,
яка виділиться під час цього процесу, позначимо через ![]() . Згідно першому
закону термодинаміки це тепло йде на збільшення
внутрішньої енергії часток газу, тобто у кінцевому рахунку на збільшення
. Згідно першому
закону термодинаміки це тепло йде на збільшення
внутрішньої енергії часток газу, тобто у кінцевому рахунку на збільшення ![]() температури газу, і
на роботу, вироблену при зміні об’єму
температури газу, і
на роботу, вироблену при зміні об’єму ![]() . Ми знайдемо елемент
. Ми знайдемо елемент ![]() (головну частину
(головну частину ![]() , лінійну відносно
, лінійну відносно ![]() и
и ![]() ), якщо
допустимо, що поглинуте тепло є сума двох кількостей
тепла: 1) того, яке
пішло на збільшення температури
), якщо
допустимо, що поглинуте тепло є сума двох кількостей
тепла: 1) того, яке
пішло на збільшення температури ![]() при
постійному об’ємі v; 2) витраченого на роботу розширення
при
постійному об’ємі v; 2) витраченого на роботу розширення ![]() при
постійній температурі Т. Перше дорівнює
при
постійній температурі Т. Перше дорівнює ![]() — теплоємність газу при постійному
об’ємі, а друге
— теплоємність газу при постійному
об’ємі, а друге ![]() .
.
Отже, при відповідному виборі одиниць виміру ![]() (*).
(*).
Символ ![]() введений тому, що, як
стане ясно з подальшого, ця величина не є повним диференціалом. Відповідно до рівняння
Менделеева – Клапейрона
введений тому, що, як
стане ясно з подальшого, ця величина не є повним диференціалом. Відповідно до рівняння
Менделеева – Клапейрона 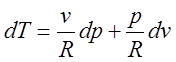
вносячи це у вираз
(*), після перегрупіровки одержимо 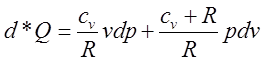 .
.
З'ясуємо зміст вирау ![]() .
З двох останніх формул при постійному тиску р, а це значить, що
.
З двох останніх формул при постійному тиску р, а це значить, що ![]() ,
знаходимо
,
знаходимо 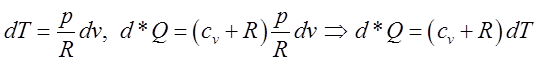 , звідки видно, що коефіцієнт при
, звідки видно, що коефіцієнт при ![]() є просто теплоемність
є просто теплоемність
![]() при постійному тиску:
при постійному тиску:![]() (**)
(**)
А тому остаточно запишемо 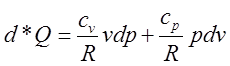 . Це і буде елементарна зміна кількості
тепла, а для того, щоб знайти зміну всього тепла, при зміні стану газу вздовж L треба проінтегрувати цей вираз по кривій L, яка є діаграмою процесу.
. Це і буде елементарна зміна кількості
тепла, а для того, щоб знайти зміну всього тепла, при зміні стану газу вздовж L треба проінтегрувати цей вираз по кривій L, яка є діаграмою процесу.
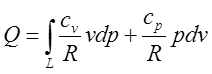 (9.4)
(9.4)
Це є відповідь на поставлене питання задачі,
але досліджуючи цей розв’язок, ми одержимо ще деякі
цікаві результати. В (9.4) умови незалежності інтеграла від шляху
інтегрування не виконуються. Дійсно, 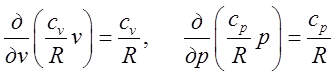 і
так, як
і
так, як ![]() , то
, то 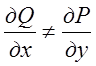 (ось чому писали
(ось чому писали![]() ).
).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.