Заканчивая рассмотрение диффузионных процессов, следует хотя бы ориентировочно оценить скорость их протекания при взвешенной плавке концентратов, учитывая не только прямые диффузионные процессы, но и обратные, также подчиняющиеся закону Фика.
Коэффициент
диффузии кислорода в воздухе при давлении 760 ![]() и температуре 0
и температуре 0![]() составляет
0,178
составляет
0,178 ![]() ,
а при 700
,
а при 700![]() - в начальной зоне печи - 1,652
- в начальной зоне печи - 1,652 ![]() . При работе печи на
воздушном дутье разность концентраций кислорода в газовой фазе и у поверхности
частицы может быть принята равной 0,21, а расход кислорода на частицу диаметром
. При работе печи на
воздушном дутье разность концентраций кислорода в газовой фазе и у поверхности
частицы может быть принята равной 0,21, а расход кислорода на частицу диаметром
![]() (масса
(масса ![]() при плотности
при плотности ![]() ) составит
) составит ![]() (или
(или ![]() на
на ![]() концентрата).
Расчеты показывают, что время молекулярной диффузии окислителя через
диффузионный слой к поверхности частицы при указанных условиях составляет на
воздушном дутье
концентрата).
Расчеты показывают, что время молекулярной диффузии окислителя через
диффузионный слой к поверхности частицы при указанных условиях составляет на
воздушном дутье ![]() . Скорость редиффузии
газообразных продуктов реакции будет достаточно близка к скорости молекулярной
диффузии кислорода. Время диффузии внутри жидкой частицы диаметром
. Скорость редиффузии
газообразных продуктов реакции будет достаточно близка к скорости молекулярной
диффузии кислорода. Время диффузии внутри жидкой частицы диаметром ![]() по зависимости А. Н. Вольского составляет
по зависимости А. Н. Вольского составляет ![]() , что сопоставимо со временем молекулярной диффузии при плавке на
кислородном дутье и значительно меньше, чем при плавке на воздушном дутье. В
последнем случае скорость диффузионных процессов будет определяться скоростью
молекулярной диффузии кислорода к поверхности сульфидных частиц.
, что сопоставимо со временем молекулярной диффузии при плавке на
кислородном дутье и значительно меньше, чем при плавке на воздушном дутье. В
последнем случае скорость диффузионных процессов будет определяться скоростью
молекулярной диффузии кислорода к поверхности сульфидных частиц.
Адсорбционные процессы подразделяют на физическую и химическую адсорбцию. При физической адсорбции взаимодействие происходит при сравнительно больших расстояниях, и адсорбированные молекулы, претерпевая небольшую деформацию, могут быть удалены с поверхности адсорбента без нарушения состава. Физическая адсорбция газов на поверхности твердого тела зависит от характера и структуры вещества и адсорбируемого газа, развитости адсорбирующей поверхности, давления газа и температуры.
Измельченные сульфидные материалы обладают достаточно
высокой адсорбционной способностью. Так, например, ![]() измельченного
до
измельченного
до ![]() халькозина адсорбирует 1,624
халькозина адсорбирует 1,624 ![]() сероводорода
и 1,082
сероводорода
и 1,082 ![]() сернистого ангидрида. Сведения по адсорбции
воздуха на сульфидах в литературе отсутствуют. Если же принять его адсорбцию
равной адсорбции сернистого ангидрида, то согласно расчетам количество адсорбированного на частицах концентрата
воздуха составляет около 0,5 % от необходимого для окисления сульфидов, что способствует начальной стадии их окисления.
Увеличение парциального давления кислорода в газовой фазе повышает его
адсорбцию. Повышение температуры уменьшает адсорбцию газов, однако, оно резко
увеличивает скорость химической адсорбции, что предупреждает десорбцию
окислителя с поверхности адсорбента.
сернистого ангидрида. Сведения по адсорбции
воздуха на сульфидах в литературе отсутствуют. Если же принять его адсорбцию
равной адсорбции сернистого ангидрида, то согласно расчетам количество адсорбированного на частицах концентрата
воздуха составляет около 0,5 % от необходимого для окисления сульфидов, что способствует начальной стадии их окисления.
Увеличение парциального давления кислорода в газовой фазе повышает его
адсорбцию. Повышение температуры уменьшает адсорбцию газов, однако, оно резко
увеличивает скорость химической адсорбции, что предупреждает десорбцию
окислителя с поверхности адсорбента.
Химическая адсорбция (хемосорбция) происходит при достаточно высоких температурах, химические силы действуют на малых расстояниях, когда молекулы газа обладают достаточной энергией для сближения с атомами адсорбента и перестройки электронного облака. Для хемосорбции характерны все черты химического взаимодействия - энергия активации, насыщенность и направленность сил, большой тепловой эффект. Хемосорбция предшествует заключительной стадии процесса - химическому взаимодействию - и приводит к образованию промежуточных комплексов, которые в зависимости от температурных условий ведения процесса окисления превращаются в те или иные конечные продукты реакции. Скорость хемосорбции прямо пропорциональна давлению газа и находится в экспоненциальной зависимости от температуры, т. е. кинетика этого процесса аналогична кинетике химического взаимодействия, которая рассматривается ниже.
Химическое взаимодействие идет
между молекулами, кинетическая энергия которых превышает энергию активации ![]() . Число
активных молекул по закону Максвелла - Больцмана
равно:
. Число
активных молекул по закону Максвелла - Больцмана
равно:
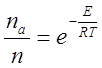 ,
,
где ![]() -
число активных молекул газа в данном объеме газа;
-
число активных молекул газа в данном объеме газа; ![]() - общее число молекул;
- общее число молекул; ![]() - основание натуральных логарифмов;
- основание натуральных логарифмов; ![]() - энергия активации;
- энергия активации; ![]() - универсальная газовая постоянная;
- универсальная газовая постоянная; ![]() - абсолютная температура.
- абсолютная температура.
Скорость гетерогенной реакции описывается уравнением:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.