f- массовая доля уноса в пыль обжига каждого элемента обожженных окатышей, доли ед.
Итого железа в обожженных окатышах
Feок=Fec/(1-f)
Железа в пыли обжига
Fen=Feок∙f
Суммируя массы всех компонентов обожженных окатышей получаем:
Feок=х∙ Feобщ.x +y∙ Feобщy.+0,5∙ Feобщ.z +10∙ Feобщ.m (кг/100кг окатышей);
Mnок=x∙ Mnобщ.x +10∙ Mnобщ.m (кг/100кг окатышей);
Sок=x∙ Sобщ.x +y∙ Sобщ.y (кг/100кг окатышей);
Pок=x∙ Pобщ.x +y∙ Pобщ.y +10∙ Pобщ.m (кг/100кг окатышей);
FeFeO=0.778∙FeO (кг/100кг окатышей);
![]() (кг/100кг окатышей);
(кг/100кг окатышей);
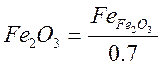 (кг/100кг окатышей);
(кг/100кг окатышей);
MnO=Mnок/0,774 (кг/100кг окатышей);
P2O5=Pок/0,437 (кг/100кг окатышей);
FeO+ Fe2O3+S+SO2+ P2O5+ MnO (кг/100кг окатышей);
Полученные данные используем для составления балансовой таблицы
5. Расчет горения мазута
В цех производства окатышей поступает мазут следующего состава, % (по объему) (Ср)м, (Нр)м, (Ор+Np)м, (Sp)м, влага (Wp)м, зола (Ар)м.
Так как
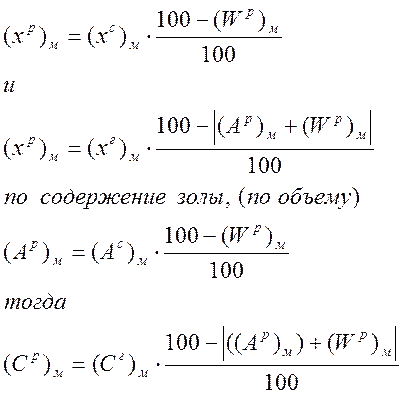
Аналогичные выражения получим для (Нр)м, (Sp)м, и(Ор+Np)м. Состав мазута в молекулярных объемах найдем следующим образом:
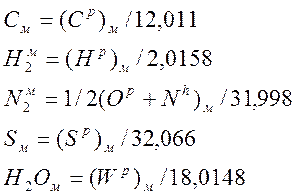
Примем, что в сумме (Ор+Np)м компоненты распределены поровну.
Теоретически необходимое количество воздуха в молекулярных объемах для сгорания 100 г. мазута
для сгорания С в СО2………………………. ВСО2 =См
для сгорания Н в Н2О……………………… ВН2О =Н2м/2
для сгорания S в SO2……………………….. ВSO2 =Sм
Итого………………………….. Вм = ВСО2+ ВН2О+ ВSO2
Требуется воздуха (в мол. объемах) с учетом О2м кислорода, имеющегося в топливе
Вм’= Вм+ О2м
Вм’’= Вм’+3.7619м
Итого В= Вм’+ Вм’’
Для сгорания 1кг. мазута требуется Вм=В·0,0224·103м3 воздуха. Состав и количество продуктов горения (в мол. объемах) 100г. мазута
СО2………………………. СО2пгм =См
Н2О ………………………. Н2Опгм = Н2Ом+Н2м
N2………………………….. N2пгм = Вм’’+ N2м
SO2………………………….. SO2пгм =Sм
Итого………………………ПГм= СО2пгм+ Н2Опгм+ N2пгм+ SO2пгм
Или [ПГ]м =ПГм·0,0224 м3
1кг. мазута дает [ПГ]м=[ПГ]м·103м3 продуктов горения
Вес продктов горения 100г. мазута
СО2………………………….. mСО’2пгм = СО2пгм ·44.0090
Н2О ………………………….. mН2О’пгм = Н2Опгм ·18.0148
SO2…………………………… mSO’2пгм = SO2пгм ·64.0640
N2…………………………….. mN’2пгм = N2пгм ·28.0134
Итого ……………………..mПГ’м= mСО’2пгм+ mН2О’пгм+ mSO’2пгм+ mN’2пгм
1 м3 продуктов горения весит:
mПГ’м=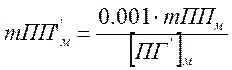
Теплоемкость данного мазута Qмр, кДж. Мазут необходимо сжигать с таким избытком воздуха, чтобы температура пламени не превышала 13500С, при более высокой температуре может опалиться верхний слой окатышей. Подсчитаем нужный избыток воздуха и количество продуктов горения.
Примем. что действительная температура (tд=13500С)состпавляет в этом случае 90% от калориметрической, тогда калориметрическая температура (tk) составит примерно 15000С. Теперь можно написать следующие уравнения:
Qнр= tk∙( СО2∙с1+ Н2О ∙с2+ SO2 ∙с3+ N2 ∙с4+Ar ∙c5)
Ar-избыток воздуха, c5- его теплоемкость
Откуда,
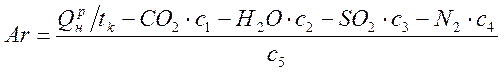 , мол. объемов воздуха, или
, мол. объемов воздуха, или
[Ar]=Ar 0,0224м3
Состав и количество продуктов горения (на 1 кг мазута)
СО2………………………….. mСО2пгм =m СО’2пгм ·10
Н2О ………………………….. mН2Опгм = mН2О’пгм ·10
SO2…………………………… mSO2пгм =m SO2пгм ·10
N2…………………………….. mN2пгм = mN’2пгм ·10+ Ar ∙0.79 ∙28.0134
О2……………………………..m О2пгм= Ar 0.21 ∙ 31.998∙
Итого …………………mПГм= mСО2пгм+ mН2Опгм+ mSO2пгм+ mN2пгм+ m О2пгм
Теперь подсчитаем количество воздуха необходимого для получения 100кг готовых окатышей.
Поступает кислорода с сырыми окатышами
О2с=О2к+О2из+О2б.
При этом О2к=( О2)к ∙0,01х; О2из=(О2)из ∙0,01y; О2б=(O2)б ∙0,01z.
Поступает серы с сырыми окатышами:
Sc=Sk ∙0.01x
Переходит серы в газовую фазу из сырых окатышей
Sгс=Sс –Sок
Теоретически требуется кислорода
для окисления Ме………………………..О12=Ос2 -Оок2
для окисления S до SO2………………….О22=0,9979 ∙Sc
Итого……………………………………Остеор= О12+ О22
С этим количеством кислорода будет введено азота
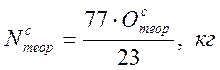
Теоретическое количество воздуха составит Вмс=Осм+Nсм,кг., или
[Втоерс]= Втеорс/1.293, м3
количество SO2 равно SO2пгм=Sс+O2
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.