В статье [16] отмечаются две противоположные тенденции: во-первых, ионная проводимость увеличивается с ростом ионного радиуса и, во-вторых, оптимальное количество лантаноида (Xmin) также увеличивается с ростом радиуса. На рисунке 5 показана минимальная величина x, которая требуется для стабилизации fcc структуры в (Bi2О3)1-x(Ln2O3)x в зависимости от ионного радиуса Ln3+.Однако высокая величина Xmin снижает ионную проводимость. По данным Саммеса [16], зависимость проводимости от ионного радиуса лантаноида имеет экстремум, который приходится на катион эрбия (рисунок 1.6).
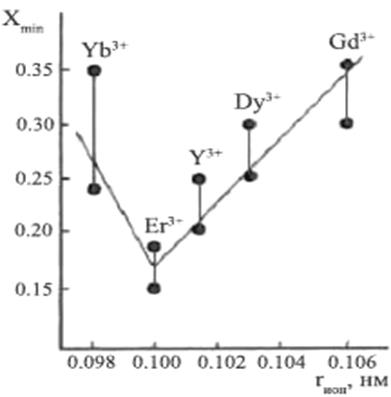
Рисунок 1.5 – Хmin как функция ионного радиуса (rион) легирующих ионов
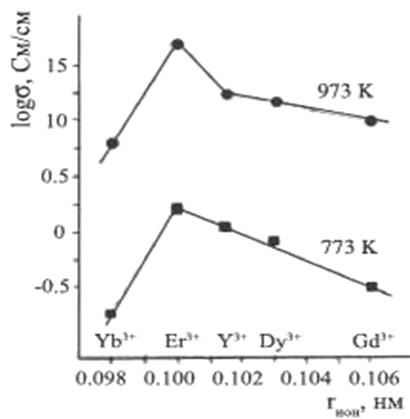
Рисунок 1.6 – Электрическая проводимость (Bi2О3)1-x(Ln2O3)x для х=Хmin в зависимости от ионного радиуса Ln3+-иона при 773 К и 973 К [9]
Веркерк, Кайзер в своих работах [17, 18] исследовали кислородную ионную проводимость (Bi2О3)1‑x(Er2O3)x в зависимости от величины легирующей добавки (x = 0,2 ÷ 0,6) и показали, что проводимость образцов уменьшается с увеличением содержания Er2О3. Проводимость в системе максимальна при х=0,2.
По мнению Ивахары [19], одну из самых высоких ионных проводимостей из всех известных систем, основанных на оксиде висмута, имеет ТОЭ (Bi2О3)1‑x(La2O3)x при x=15 мол.% La2O3. Имеется много работ по исследованию системы Bi2О3- La2O3 [19-22], но, тем не менее, до сих пор нет однозначных данных относительно типа формируемой структуры. Качен и др. [20], исходя из большого ионного радиуса La3+ (1.18 Ǻ [25]), предположили, что при стабилизации лантаном всегда образуется ромбическая структура Bi2О3, Ивахара и др. [19] подтвердили, что при стабилизации 15-28 мол. % La образуется только фаза ромбического типа. Однако, Ватанаба [21] в области 21,5-23,5 мол.% La2O3 обнаружил фазу с гексагональной слоистой структурой, также Курсон [22] показал, что при стабилизации Bi2О3 17,5 мол.% La образуется гексагональная структура, которая обладает хорошей ионной проводимостью (8·10-2 См/см при 873 К), как fcc или ромбическая структуры.
На основании анализа литературных данных можно сделать вывод, что электрические свойства ТОЭ сильно зависят от природы лантаноида и его количества.
1.3 Теория кристаллизации. Равновесие и превращение фаз
1.3.1 Фазы и компоненты
Физическая система, в которой происходят процессы роста кристаллов, в общем случае содержит несколько веществ, причем каждое вещество может находиться в разных агрегатных состояниях. Такие системы термодинамика определяет как многофазные и многокомпонентные.
Фазой называют макроскопическую однородную (гомогенную) часть вещества, отделенную от других частей поверхностью раздела. Системы, в которых число фаз больше одной, называются гетерогенными (неоднородными).
Компонентами называются химические соединения, составляющие рассматриваемую систему. В системе может быть несколько компонентов, несколько твердых и жидких фаз, но только одна газообразная. Примером такой системы является изолированный сосуд, заполненный водой с плавающими в ней кусочками льда. Здесь фазы — это вода, лед и пары воды. Компонентом является Н2О. Введение в сосуд нескольких капелек ртути приводит к появлению в системе еще одного компонента. Теперь система представляет собой совокупность одной твердой, двух жидких фаз и газообразной (пары ртути и воды) фазы.
Образование кристаллов представляет собой фазовый переход, при котором изменяется агрегатное состояние вещества. Обычно различают фазовые переходы первого и второго рода. Характерным признаком фазовых переходов первого рода является то, что эти переходы сопровождаются изменением удельных объема и энтропии вещества, которые происходят скачком. Так как происходит скачкообразное изменение удельной энтропии системы, то при фазовом переходе имеет место выделение или поглощение тепла. Это означает, что для характеристики фазовых переходов первого рода важнейшей характеристикой является удельная теплота перехода. При фазовых переходах второго рода удельные объемы и энтропия меняются непрерывно.[33] Это означает, что при фазовых переходах второго рода не существует теплоты перехода. Однако при фазовых переходах второго рода скачком изменяются некоторые физические свойства вещества, такие как теплоемкость, коэффициент теплового расширения, изотермическая сжимаемость.
Фазовый переход можно рассматривать как переход системы из неравновесного состояния в равновесное. Этот переход может протекать при тех или иных ограничениях, налагаемых на параметры системы. Для замкнутых систем характерно постоянство объема системы: V = const. Это условие выполняется, например, при кристаллизации из пара в изолированном сосуде. Для открытых систем, каковыми являются растворы и кристаллы, растущие в них, обычно сохраняется постоянным давление Р.[34]
В расположении атомов в жидком металле нет той закономерности, которая характеризует твердое (кристаллическое) тело. В жидкости наблюдается тенденция к правильному расположению атомов. Каждый атом окружен некоторым числом атомов-соседей, находящихся от него на определенном расстоянии, характерном для данной температуры. Однако вследствие интенсивного теплового движения атомов такое соседство постоянно нарушается и вновь возникает.
Разделение всего объема жидкости на группы и геометрически правильное строение каждой из них называют одним термином — ближний порядок — мигрирующее состояние, связанное с укладкой атомов, воспроизводящих кристаллическую решетку в микрообъеме (несколько межатомных расстояний) в некоторый незначительный период времени. При нагреве жидкости степень ближнего порядка в ней снижается.
Ближнему порядку противопоставляют дальний порядок, наблюдаемый в твердых телах. Постоянство межатомных расстояний и угловых соотношений при дальнем порядке сохраняется на больших (макроскопических) расстояниях [40].
1.3.3 Возникновение новой фазы. Рост и равновесная форма кристаллов
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.