Другая модель разупорядочения: атом поверхностного слоя, приобретая избыток энергии от соседей легко испаряется из кристалла или еще легче переходит в адсорбционный слой. Через некоторое время на место атома поверхностного слоя переходит соседний атом из более глубокого слоя. Таким путем образуется вакансия, переходящая в глубь кристалла. В этом случае источниками вакансий являются свободные поверхности кристалла, пустоты и трещины вокруг него – дефект Шоттки.
Концентрации дефектов Френкеля и Шоттки невелики – максимальная доля не превышает нескольких десятых процентов. За счет этого электропроводность твердых тел с собственной разупорядоченностью даже в области температур, близких к температуре плавления, остается малой.
В кристаллической решетке также бывает нарушение периодичности, которое связано с размещением атомов в чужих узлах, то есть в позициях, предназначенных для атомов другого сорта. Этот вид дефектов получил название антиструктурных. В трехкомпонентных соединениях антиструктурные дефекты возникают при обмене местами двух катионов, принадлежащих к различным подрешеткам кристалла.
В реальном кристалле возникновение точечных дефектов является следствием всегда неизбежного контакта кристалла с окружающей средой и обмена с ней энергией или веществом. За счет присутствия в кристалле различного рода примесей возникают примесные точечные дефекты. Среди примесных дефектов особое значение для твердых электролитов имеют вакансии, образующиеся в твердых растворах при замене основного иона ионом-заместителем другой степени окисления. В этом случае при сохранении кристаллической структуры вещества в одной из подрешеток непременно должны возникать вакансии.
Твердые оксидные электролиты являются нестехиометрическими фазами с высокой разупорядоченностью анионной (кислородной) подрешетки. Наличие вакансий в ТОЭ приводит к возможности перемещения ионов кислорода из занятого узла в пустой и сопровождается переносом, как заряда, так и массы. Вероятность перескоков ионов кислорода в этом случае оказывается пропорциональной концентрации вакансий, следовательно, частицами, ответственными за перенос тока в рассматриваемых системах, являются кислородные вакансии. Поэтому механизм переноса ионов кислорода в ТОЭ является вакансионным.
Известны твёрдые оксидные электролиты на основе ZrO2, CeO2, Bi2O3 . Важнейшей особенностью ТОЭ на основе Bi2O3 является работоспособность в области низких температур 600¸800 К, в которой использование других ионных проводников не эффективно. Возможность конструирования низкотемпературных электролитов обусловила повышенное внимание к исследованию этих материалов.
Структура и свойства оксида висмута (III)
Вi2О3 – устойчивый в обычных условиях оксид светло-желтого цвета. Оксид висмута обладает сложным полиморфизмом, довольно инертен, нерастворим в воде, растворах щелочей и большинства минеральных кислот, хорошо растворим в концентрированных хлороводородной и азотной кислотах, причем растворение значительно ускоряется при нагревании. Температура плавления 1103 ± 3 К [7].
Известны 4 модификации оксида висмута – стабильные: моноклинная a-Вi2О3 и гранецентрированная кубическая d-Вi2О3 и метастабильные: тетрагональная b-Вi2О3 и объемно-центрированная кубическая g-Вi2О3. Полиморфные превращения Bi2O3 сопровождаются выделением или поглощением О2 и поэтому зависят от давления О2 [8].
Наибольший интерес представляет d-фаза Bi2O3, поскольку имеет высокую электропроводность по ионам кислорода (~ 1 См/см при 1023 К), которая в работах[8,9] объясняется структурной разупорядоченностью фазы.
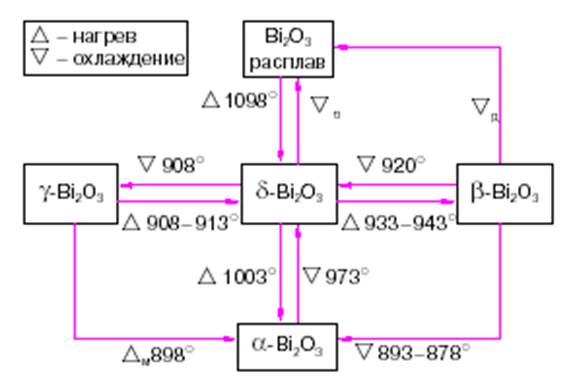
Рисунок 1.1 – Схема фазовых превращений в оксиде висмута[9]
Мэйрэсс [11] выделил следующие причины высокой проводимости по ионам кислорода в d-Bi2O3:
1.
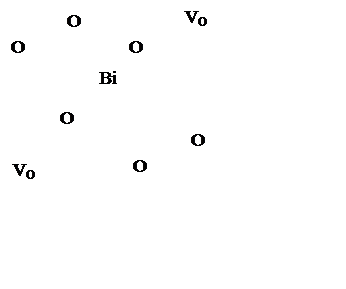 1/4
местоположений кислорода в решетке флюоритного типа являются вакантными
(рисунок 2). Из 8 позиций атомов кислорода в ячейке 2 свободны;
1/4
местоположений кислорода в решетке флюоритного типа являются вакантными
(рисунок 2). Из 8 позиций атомов кислорода в ячейке 2 свободны;
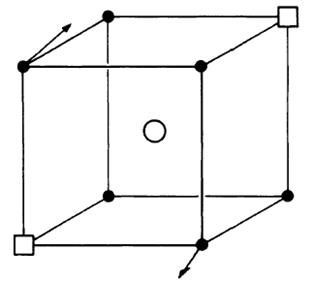
Рисунок 1.2 – Координация вокруг атома Bi в Bi2O3 [12]
2. электронная структура Bi3+ характеризуется присутствием 6s2 неподеленной электронной пары, приводящей к высокой поляризуемости катионной подрешетки, которая приводит к подвижности ионов кислорода;
3. отличная способность иона Bi3+ создавать высоко разупорядоченное окружение.
1.2 Система Bi2O3 – La2O3
К настоящему времени имеется много работ [13, 14, 15, 16, 17-23] по поиску оптимальных составов электролитов на основе Bi2O3. Они позволяют сделать следующие обобщения:
· Полученные твердые растворы стабильны в гораздо более широком диапазоне температур по сравнению с чистым Bi2O3;
· При стабилизации с повышением концентрации катиона-заместителя температурная область существования d-Bi2O3 твердого раствора возрастает, однако проводимость электролита при этом уменьшается;
· Чем больше различие радиусов Bi3+ (0,096 нм [20]) и иона-заместителя, тем сильнее искажается решетка и тем меньше требуется добавки для стабилизации d-Bi2O3 [16].
Из литературных данных известно, что фазы на основе Bi2О3, содержащие Ln2О3, могут иметь различные типы структур. Тип сформированной структуры зависит, прежде всего, от природы легирующей добавки и её концентрации. Как правило, такие электролиты имеют гранецентрированную (fcc) (тип флюорита – рисунок 1.3) или ромбическую решетки в зависимости от концентрации и радиуса иона легирующей добавки (рисунок 1.4). Установлено, что ромбическая фаза формируется в случае относительно большого радиуса иона Ln3+, а fcc структура – в случае относительно малого. Катионные радиусы лантаноидов увеличиваются от 0.97 Ǻ для Lu3+ до 1.18 Ǻ для La3+ [25].
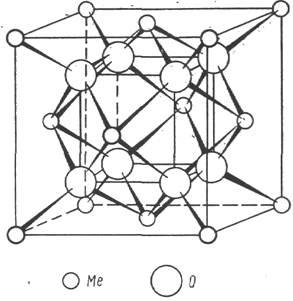
Рисунок 1.3 – Структурный тип флюорита [24]
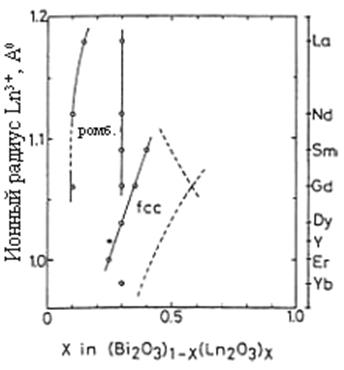
Рисунок 1.4 – Формирование областей ромбической и кубической фаз Bi2О3 в зависимости от ионного радиуса Ln3+ и величины Х [16]
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.