Было изучено огромное число стеклообразных материалов, проявляющих полупроводниковые свойства. Одними из наиболее простых представителей этой группы материалов являются халькогенидные стекла, такие, как As2S3, As2Se3 и As2Te3. Из-за их относительно простой структуры значительная часть фундаментальных исследований полупроводниковых стекол была проведена именно на них, в особенности на As2S3. Позже к себе привлекли внимание намного более сложные стекла, такие, как Te81Ge51A4, где A — это обычно элемент V группы периодической системы элементов. Интерес к этим материалам был вызван их применениями в переключателях и запоминающих устройствах. Более простые стекла, однако, дают нам лучшую возможность разобраться в сложных физических проблемах, которые возникают при изучении этого класса материалов, поэтому мы ограничимся в своем обсуждении только этими материалами.
Электропроводность
полупроводников этого типа можно описать экспоненциальным законом 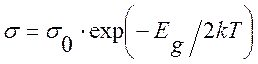 при изменении σ в пределах 4—6
порядков величины. Если отвлечься от отклонений от этого закона, которые
наблюдаются при низких температурах, становится ясно, что для возникновения
проводимости требуется термическая активация. Величина Еgприблизительно равна ширине зоны, полученной с помощью оптических
измерений, однако в точности с ней не совпадает. Эти результаты укладываются в
предложенную модель и показывают, что уровень Ферми в собственном материале
расположен вблизи середины запрещенной зоны (из-за того, что в знаменателе
показателя экспоненты стоит величина 2kT).
при изменении σ в пределах 4—6
порядков величины. Если отвлечься от отклонений от этого закона, которые
наблюдаются при низких температурах, становится ясно, что для возникновения
проводимости требуется термическая активация. Величина Еgприблизительно равна ширине зоны, полученной с помощью оптических
измерений, однако в точности с ней не совпадает. Эти результаты укладываются в
предложенную модель и показывают, что уровень Ферми в собственном материале
расположен вблизи середины запрещенной зоны (из-за того, что в знаменателе
показателя экспоненты стоит величина 2kT).
Значения электропроводности при комнатной температуре сильно отличаются друг от друга, Но обычно имеют величину порядка 10-8 Ом-1·см-1 и уменьшаются примерно до 10-8 Ом-1·см-1 при 150К. Значения подвижностей (обычно это μн) при комнатной температуре также довольно различны, но лежат в пределах 0,1—0,01см2·В-1·с-1 и не так быстро уменьшаются при понижении температуры (менее чем в десять раз между 300 и 150 К). Очевидно, эти материалы не очень чувствительны к введению химических примесей. Электропроводность и подвижность носителей заряда в сплавах обычно оказывается ниже, чем в исходных материалах [3].
6. Халькогенидные стёкла
Уже опубликовано значительное количество экспериментальных работ по кинетическим свойствам аморфных полупроводников. Большинство исследований было проведено на двух группах веществ, а именно на полупроводниках с тетраэдрической координацией связей, в частности в аморфных Si и Gе, а также на халькогенидных стеклах.
Стёкла, основанные на халькогенидах S, Sе и Te, могут быть легко изготовлены двумя различными способами: напылением в вакууме (в виде тонких пленок) или катодным распылением и закалкой из расплава. Аморфные халькогениды и им подобные полупроводники могут быть приготовлены в объемной форме быстрым охлаждением из расплава, почему их и называют стеклами. Это свойство тесно связано с химическими связями и электронной структурой таких веществ: для образования стекла необходимо, по-видимому, присутствие в структурной сетке атомов с координационным числом меньше четырех. Тогда сравнительно малой энергии достаточно, чтобы расположить атомы с двумя или тремя связями так, что в конечном итоге образуется трехмерная структурная сетка. Этот принцип реализуется в его наиболее чистом виде в аморфном SiO2, который можно считать самым типичным стеклом. Типичным же стеклообразным полупроводником является As2Se3. Схема его химических связей показана на рис. 5.
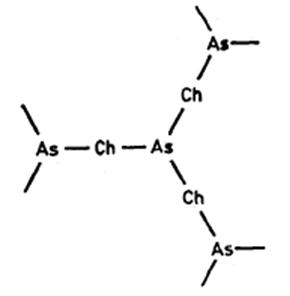
Рис. 5. Упрощённая структура
As2Ch3 (Ch — халькоген).
Широко изучались бинарные системы Аs—S, Аs—Sе и Аs—Te, включая соединения As2S3, As2Se3 и As2Te3. Трех- и четырехкомпонентные системы, содержащие элементы S, Se, Те, As, Ge и Т1 и др., также могут быть приготовлены в стеклообразном состоянии. Многокомпонентные системы, например As3Te4,8Si1,2Ge1, имеют большое практическое значение благодаря своим свойствам переключения и памяти. В общем случае халькогенидные стекла обладают хорошей термической стабильностью, например As2S3 может переводиться из твердого в жидкое состояние без кристаллизации.
В стеклообразном состоянии атомы халькогенов обладают хорошо определенным координационным числом. В основном состоянии электронная конфигурация элементов S, Se и Te есть s2p4. В стеклах типа A2VB3VI (A = As, Sb; В = S, Se, Te) структура представляет собой сетку с полностью насыщенными двумя и тремя ковалентными связями элементов BVI и AV. Каждый из атомов халькогена связан с двумя атомами As, а каждый из атомов As — с тремя халькогенами. Из-за координации с двумя связями у каждого из атомов халькогена остается пара несвязанных электронов — так называемая одиночная парная орбиталь. Эта свободная пара электронов не принимает участия в образовании химических связей. Органическим следствием методик приготовления халькогенидных стекол является присутствие в них большого числа дефектов, таких, как вакансии, разорванные связи и атомы без связей. Эти дефекты должны, очевидно, приводить к образованию относительно определенных энергетических уровней в щели подвижности, что приведет к плотности состояний, обладающей рядом пиков [1].
Было предложено несколько моделей зонной структуры аморфных полупроводников, которые в некоторой степени сводятся к одной в том смысле, что все они основаны на представлении о локализации состояний в зонных хвостах. Тем не менее, существуют различные точки зрения на величину этих хвостов. На рис. 6 схематически проиллюстрированы основные особенности различных моделей.
Модель Коэна—Фрицше—Овшинского
В модели КФО, показанной на рис. 6, а, принимается, что хвосты плотности состояний перекрывают всю запрещенную зону, а зависимость плотности состояний от энергии однородная. Постепенное уменьшение плотности локализованных состояний разрушает резкие края зоны проводимости и валентной зоны. Модель КФО была предложена специально для многокомпонентных халькогенидных стекол, используемых в переключающих устройствах.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.