При исследовании термодинамических процессов часто приходится иметь дело с газовыми смесями, представляющими механическую смесь отдельных газов, не вступающих между собой в химическую реакцию. Характеристиками смеси могут быть: парциальные давления составляющих, молекулярные массы и газовая постоянная.
Парциальным давлением называют такое давление, которое имел бы каждый газ, входящий в состав смеси, при условии, если бы этот газ находился один в том же количестве и при той же температуре, занимая объем всей смеси.
В соответствии с законом Дальтона общее давление смеси газов Р равно сумме давлений отдельных газов рi составляющих смесь, т. е.
Р = ![]() pi
(11.4)
pi
(11.4)
Газовые смеси обладают свойством аддитивности. Поэтому их состав может быть задан массовыми, объемными или мольными долями. Массовой долей называют отношение массы каждого газа к массе смеси, т. е.
![]()
Объемная доля г, представляет собой отношение парциального объема каждого газа V, к объему смеси V. Поэтому
![]()
Аналогичные соотношения можно записать и для выражения состава смеси в мольных долях, представляющих собой отношение числа киломолей каждого газа Мi к числу киломолей смеси М, т. е. gi = Мi/М. Так как
r = р/RТ, то
![]()
где R - газовая постоянная смеси газов, равная сумме произведений массовых долей каждого газа на газовую постоянную этого же газа, т. е.
![]()
Значение R можно определить по средней молекулярной массе смеси
![]()
Парциальное давление отдельных газов смеси рi = рgimi/ m=p ri
Для реальных газов получено много различных уравнений состояния. Зачастую они очень сложны и неудобны для применения. В металлургических печах давления газов невелики. Поэтому их можно рассматривать как идеальные.
Теплоемкость вещества представляет собой отношение количества тепла, подведенного к рабочему телу в каком-либо процессе, к изменению температуры тела, т. е. с = dq/dT.
Так как dq = du + dl = du + р du, то с= (du/dT) + р (du /dT).
При u= const изменение внутренней энергии du = cu dT.
Поэтому для идеального газа с = cu + р (du /dT). При дифференцировании уравнения Клапейрона по температуре получим,что (du /dT)p=const = R/р- Тогда
сp= cu +R. (11.8)
Эту зависимость называют уравнением Майера. Здесь сp и cu - теплоемкости газов при постоянном давлении и при постоянном объеме. Отсчет теплоемкостей производят от 0° С.
При умножении уравнения Манера на молекулярную массу газа m получим m сp - m cu =mR= 8314,2 Дж/(кмоль.°С). Здесь(m сp - мольная теплоемкость при постоянном давлении; m cu - мольная постоянная при постоянном объеме.
Отношение сp к cu называют показателем адиабаты k:
![]()
Теплоемкости газов изменяются с изменением температуры. Поэтому и показатель адиабаты k также будет меняться при изменении температуры газа.
В расчетах используют массовые, объемные и мольные теплоемкости, обозначаемые с, С и cm Они имеют размерности: Дж/(кг °С), Дж/м3°С ) и Дж/(кмоль °С). Между теплоемкостями существуют соотношения:
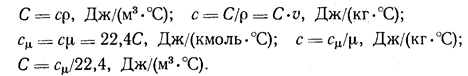
Теплоемкости смесей газов, заданных массовыми или объемными долями, на основании аддитивности определяются выражениями:
![]()
Теплоемкости подразделяюг на истинные и средние. Истинной теплоемкостью называют отношение бесконечно малого количества теплоты к бесконечно малому изменению температуры. Средней теплоемкостью называют отношение количества теплоты, воспринятой телом, к конечному изменению температуры, т. е.
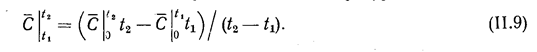
2.3. Термодинамические процессы идеальных газов
В соответствии с первым законом термодинамики подводимая к рабочему телу теплота расходуется на изменение его внутренней энергии и на совершение работы. При этом меняется состояние газа.
Для всех изопроцессов установлен общий метод исследования. Вначале выводят уравнения процесса в координатах рu и Тs. После этого определяют внутреннюю энергию газа и работу изменения его объема. Затем вычисляют количество теплоты в процессе и изменения энтальпии и энтропии.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.