Поэтому можно только утверждать что энергия
подсистемы (или системы) определяется каким-т достаточно узким
интервалом между Е и Е+ ![]() E , где Е>>
E , где Е>>![]() Е. Кроме того, все состояния с
различной энергией характеризуются и различными вероятностями.
Если нескольким различным состоянием системы отвечает одна и та же
энергия, то такие состояния называются в ы р о ж д е н н ы м и, а
число состояний с одной и той же энергией называют к р а т н о с т ь ю в
ы р о ж д е н и я или с т а т и с т и ч е с к и м в е с о
м.
Е. Кроме того, все состояния с
различной энергией характеризуются и различными вероятностями.
Если нескольким различным состоянием системы отвечает одна и та же
энергия, то такие состояния называются в ы р о ж д е н н ы м и, а
число состояний с одной и той же энергией называют к р а т н о с т ь ю в
ы р о ж д е н и я или с т а т и с т и ч е с к и м в е с о
м.
Величина ![]() Е достаточно мала ,
поэтому в интервале энергий Е +
Е достаточно мала ,
поэтому в интервале энергий Е +![]() Е все состояния
системы могут быть приняты равновесными. Пусть Qm - вероятность нахождения
системы в определенном энергетическом состоянии. Эта вероятность равна
отношению числа возможных состояний, при которых система имеет энергию в
интервале [Em-(Em
Е все состояния
системы могут быть приняты равновесными. Пусть Qm - вероятность нахождения
системы в определенном энергетическом состоянии. Эта вероятность равна
отношению числа возможных состояний, при которых система имеет энергию в
интервале [Em-(Em![]()
![]() E), к общему числу состояний системы
E), к общему числу состояний системы ![]() или
или
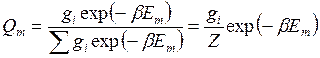 (14.25)
(14.25)
где ![]() (14.26)
(14.26)
-с т ат и с т и ч а с к а я с у м м а термодинамической: системы, определяемая суммированием по энергетическим состояниям; Е 1, Е2 , ..., Еi - энергии, соответствующие различным степеням свободы системы.
В общем случае энергия атома или молекулы состоит из энергии поступательного движения Е и энергии внутренних степеней свободы Е :Е=Е + Е , а статистическая сумма по состояниям имеет вид
![]() (14.27)
(14.27)
Статистическая сумма по состояниям энергии поступательного движения для газа объемом V
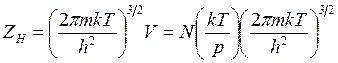 (14.28)
(14.28)
Для определения статистической суммы по состояниям внутренней энергии необходимо знать, из чего складывается энергия внутренних степеней свободы. Пусть, например, система состоит из атомов н двухатомных молекул. У атомов энергии внутренних степеней свободы складывается из энергии возбужденных электронных состояний Е0,Е1,...,Еm, соответствующих различным электронным конфигурациям. Статистическая сумма по возбужденным электронным состояниям в этом случае будет иметь вид
![]() (14.29)
(14.29)
Для многих задач можно ограничиться только первым членом соответствующим основному состоянию E=0. В этом случае
![]() (14.30)
(14.30)
Тогда для одноатомных газов
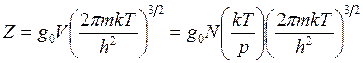 (14.31)
(14.31)
Здесь N - число атомов в системе; h и k- постоянные Планка и Больцмана; m- относительная атомная масса.
В отличие от атомов, обладающих энергетическими состояниями только одного типа, энергия внутренних степеней свободы двухатомных молекул складывается из энергии возбужденных электронных состояний Еi, энергии колебания ядер атомов относительно друг друга Еk, энергии вращения ядер относительно центра тяжести молекулы Евр . В этом случае
![]() (14.32)
(14.32)
![]() где
где
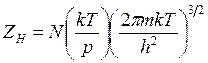
![]()
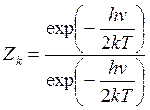
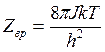 (14.33)
(14.33)
где J - момент
инерции молекулы; ![]() - частота
колебаний.
- частота
колебаний.
Таким образом, для вычисления статистической суммы по состояниям любой системы необходимо знать допустимые состояния и уровни энергии. При вычислении этой суммы каждое состояние рассчитывается отдельно, поэтому статистическая сумма состояний N систем может быть получена из параметров, определенных для одной молекулы путем возведения в степень N :
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.