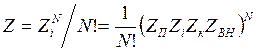 (14.34)
(14.34)
Распределение вероятностей, как следует из
определения, должно быть при этом равно единице ![]() .
.
Пусть
взаимодействуют друг с другом две системы, которые находятся в
тепловом равновесии и, следовательно, обладают одинаковой температурой.
Из анализа выражений (14.25) и (14.26) видно, что у таких систем одинаковы
значения параметра ![]() . Можно показать, что параметр
. Можно показать, что параметр ![]() является функцией температуры и равен
является функцией температуры и равен
![]() =1/(kT). Это дает
возможность представить распределение любых систем (молекул, атомов, ионов и
др.) по энергетическим состояниям в виде
=1/(kT). Это дает
возможность представить распределение любых систем (молекул, атомов, ионов и
др.) по энергетическим состояниям в виде
![]() (14.35)
(14.35)
Выражения (14.25) и (14.35) являются различными формами записи к в а н т о в о г о канонического р а с п р е д е л е н и я Г и б 6 с а, которое характеризует распределение вероятностей различных состояний систем, находящихся в статистическом равновесии.
Распределение Гиббса позволяет определять среднее значение любого физического параметра, явно зависящего от состояния системы. Так, если какой-то параметр при энергии Еm имеет значение Qm , то выражение для определения его среднего значения получит вид
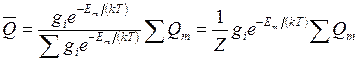
Для систем с большим числом частиц распределение Гиббса имеет резкий максимум при некотором значении энергии. Состояние, отвечающее этому максимуму, является наиболее вероятным, и именно оно вносит основной вклад в среднее значение любого параметра. Если систему составляют молекулы идеального газа, то распределение Гиббса переходит в распределение Больцмана(14.20)
7.5. Определение термодинамических параметров статистическими методами
Статистическая термодинамика позволяет определить значения термодинамических параметров любой системы с использованием полученных зависимостей и статистических характеристик. Как уже отмечалось, одной из Важнейших характеристик термодинамических систем является статистическая сумма по состояниям Z, значения которой зависят исключительно от молекулярных свойств системы, а именно: возможных энергетических состояний, температуры Т и давления р. Это дает основание использовать статистическую сумму для определения значений любых термодинамических параметров. Свободная энергия F является функцией состояния системы. Поэтому статистическая сумма по состояниям может быть представлена в виде
![]() (14.36)
(14.36)
Отсюда
![]() (14.37)
(14.37)
Это выражение является основным для определения термодинамических параметров статистическими методами, с помощью которых, учитывая известные связи свободной энергии с термодинамическими параметрами, можно найти: уравнение состояния системы
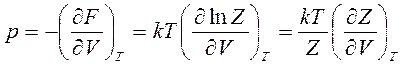 (14.38)
(14.38)
энтропию
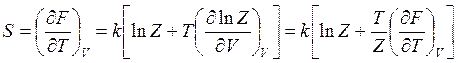 (14.39)
(14.39)
внутреннюю энергию
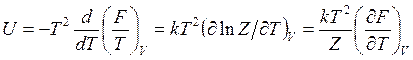 (14.40)
(14.40)
энтальпию
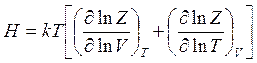 (14.41)
(14.41)
теплоемкость при постоянном объеме
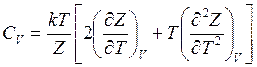 (14.42)
(14.42)
теплоемкость при постоянном давлении
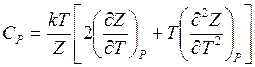 (14.43)
(14.43)
изобарно-изотермный потенциал
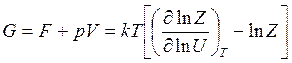 (14.44)
(14.44)
Таким образом, при известном выражении для статистической суммы Z любой системы ее термодинамические параметры определяются выражениями (14.37) - (14.44) однозначно.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.