|
Уравнение реакции |
∆Но, кДж/моль |
№ |
|
(CH2OH)2 → (C(O)H)2 + 2H2 ↑ (CH2OH)2 + O2 → (C(O)H)2 + 2H2O (CH2OH)2 + 3O2 → 2CO2 ↑ + 3H2O (CH2OH)2 → 2CO ↑ + 3H2 ↑ (C(O)H)2 + 3/2O2 → 2CO2 ↑ + H2O (C(O)H)2 → 2CO ↑ + H2 ↑ O2 + 2H2 → 2H2O (CH2OH)2 → CH3COH + H2O (CH2OH)2 +0.5O2 → HOCH2C(O)H + H2O (C(O)H)2 + 0.5O2 → H(O)CCOOH HOCH2C(O)H + 0.5O2 → HOCH2COOH (CH2OH)2 + 0.5O2 → 2H2CO + H2O (CH2OH)2 → 2H2CO + H2 ↑ |
-142.19 -363.27 -1178.6 -131.2 -815.28 -11.0 -252.73 -81.07 - - - -157.03 - 95.7 |
1 2 3 4 5 6 7 8 9 10 11 12 13 |
Все эти превращения имеют место в силу высокой реакционной способности молекул этиленгликоля и, особенно, продуктов его окисления — глиоксаля, гликолевого альдегида, ацетальдегида и др. При реализации процесса окисления этиленгликоля в условиях высоких температур до 650—700 оС наблюдается появление на продуктах реакции метана, этилена.
В целом процесс протекает по последовательно-параллельной схеме:
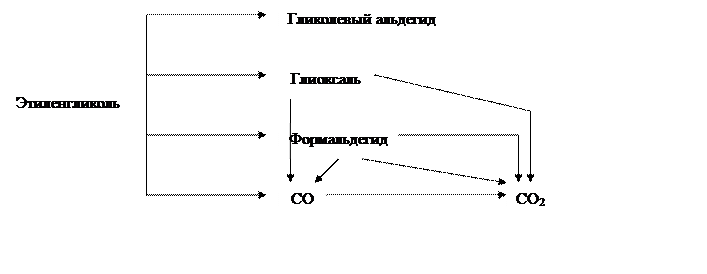 |
с образованием широкого спектра побочных продуктов.
1.3.2 Параметры, влияющие на эффективность процесса парофазного каталитического окисления этиленгликоля.
В промышленности синтез глиоксаля окислением этиленгликоля протекает в адиабатических условиях, оптимальный температурный режим процесса зависит от содержания О2в реакционной смеси. Устойчивый автотермический режим реализуется в сравнительно узком температурном интервале, который зависит от природы используемой каталитической системы. Ниже нижнего предела происходит «затухание» процесса, падение конверсии этиленгликоля до 10%, в то же время выше верхнего предела — падение селективности по глиоксалю за счет термического разложения целевого продукта и повышения выхода продуктов глубокого окисления (СО и СО2). Пределы взрывоопасности смеси этиленгликоля в воздухе составляют от 3,6 до 9,2 % об.[2].
При температуре менее 400 оС на всех исследованных катализаторах даже при достаточно высоком содержании кислорода в системе конверсия этиленгликоля мала. При Т - 400 ÷ 450 оС наблюдается самопроизвольный разогрев реакционной зоны. Устойчивое протекание процесса при 500 оС возможно лишь в условиях невысокого содержания кислорода в системе (О2/ЭГ - 0,7 ÷ 0,8). Сравнение эффективности металлических систем показало, что наиболее высокого выхода целевого продукта удаюсь достигнуть на двухслойном катализаторе, в то время как самое низкое значение выхода глиоксаля характерно для массивного Сu катализатора.
Для исследованных каталитических систем наблюдается максимум по селективности и выходу глиоксаля с температурой, связанный с ростом доли глубокого окисления и термического разложения глиоксаля до СО и Н2, согласно уравнениям (4), (6), при увеличении температуры процесса.
Снижение выхода СО2 происходит с ростом температуры на Ag катализаторе, что может быть связано с рекристаллизацией поверхности серебряного катализатора. На массивном Ag катализаторе конверсия этиленгликоля практически не зависит от увеличения температуры в условиях повышенного содержания кислорода в реакционной смеси.
Воздействие высокотемпературной реакционной среды приводит к формированию селективных центров на поверхности серебра, однако спекание поверхности, в свою очередь, сопровождается потерей активности, то eсть снижением конверсии этиленгликоля. Следовательно, такой способ повышения селективности нерационален, более выгодным методом является использование смешанной Cu-Ag системы, либо модифицирование серебряных катализаторов путем добавления промотора.
Более высокое значение оптимальной температуры процесса для двухслойной системы по сравнению с индивидуальными металлами связано с взаимным влиянием Сu и Ag в составе смешанного катализатора. Несмотря на использование 50% раствора этиленгликоля, наличие слоя меди в составе катализатора обеспечивает более высокую степень превращения этиленгликоля в глиоксаль по сравнению с серебром.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.