4(СНО)2 + 2HNО3 → 4СНОСООН + N2O + Н2О. (1.5)
Для инициирования начала реакции необходимо присутствие нитрата либо нитрита натрия, при взаимодействии которого с азотной кислотой выделяется необходимое для начала процесса количество закиси азота. Таким образом, нитрат или нитрит натрия играет роль катализатора. В ходе процесса окисления добавки азотнокислого натрия (либо другого соединения) не требуется, так как достаточное количество закиси азота образуется в результате взаимодействия ацетальдегида с азотной кислотой.
В качестве высокоселективного катализатора для превращения ацетальдегида в глиоксаль используется диоксид селена SeO2. В присутствии селенсодержащего катализатора наблюдается увеличение конверсии ацетальдегида с 4 до 10%. Однако регенерация SeO2 представляет достаточно серьезную проблему, вследствие того, что в ходе процесса окисления образуются трудно восстанавливаемые органические соединения селена. Для повышения выхода целевого продукта в реакционную смесь добавляют муравьиную и уксусную кислоты в мольном соотношении с азотной кислотой от 0,5 до 1,16. Это позволяет увеличить выход глиоксаля до 50%. Следует отметить, что для данной реакции оптимальный температурный диапазон лежит в узких пределах 45 ÷ 48 оС. Дальнейшее увеличение температуры приводит к заметному уменьшению выхода целевого продукта.
В качестве катализаторов предложены соли металлов I группы Периодической системы: нитраты натрия, лития, серебра. Получаемая смесь продуктов представляет собой водный раствор альдегидов, уксусной кислоты, азотной и малого количества азотистой кислоты. Альдегидные соединения включают Глиоксаль, ацетальдегид и глиоксалевую кислоту.
Недостаток этого метода получения — периодичность процесса. Кроме того, важнейшей проблемой является очистка полученной смеси разнообразных продуктов. Для получения товарного продукта (40%-ный водный раствор глиоксаля) необходимо удалять из смеси азотную и уксусную кислоты, например, методом ионного обмена. Выделение глиоксаля из продуктов реакции стандартными методами невозможно. В мировой практике данная технология получения глиоксаля применяется очень ограниченно в связи с большими выбросами оксидов азота в атмосферу, которые разрушают озоновый слой, защищающий земную поверхность от УФ – излучения.
1.2.2 Озонирование бензола
|
|
Существуют разработки метода синтеза глиоксаля озонированием бензола эквивалентным количеством озона с дальнейшим гидрированием получаемых продуктов для получения глиоксаля. Бензол присоединяет озон, образуя триозонид — чрезвычайно взрывчатое вещество. Под действием воды озонид разлагается с образованием трех молекул глиоксаля по схеме [1]:
Однако из-за высокой себестоимости получения озона и чрезвычайной взрывоопасности этот метод не представляет практической ценности.
1.2.3 Окисление глицерина хромовой кислотой
Еще одним возможным методом получения глиоксаля является окисление глицерина хромовой кислотой в присутствии серной кислоты при комнатной температуре. Наряду с глиоксалем образуется формальдегид в соответствии с уравнением реакции:
2Сr2 О72- + ЗНОСН2СН(ОН)СН2ОН + 16Н4↔ 4Сr3- + 3(СНО)2 + ЗН2СО + 14H2О (1.6)
Скорость реакции окисления возрастает с увеличением концентрации ионов водорода. Предполагается, что активной окисляющей формой в реакции (1.6) является шестивалентный хром однозарядного иона HcrO3-. При исследовании реакции окисления глицерина были обнаружены свободные радикал-ионы, показывающие, что реакция окисления глицерина шестивалентным хромом может проходить по механизму как одно-, так и трехэлектронного переноса.
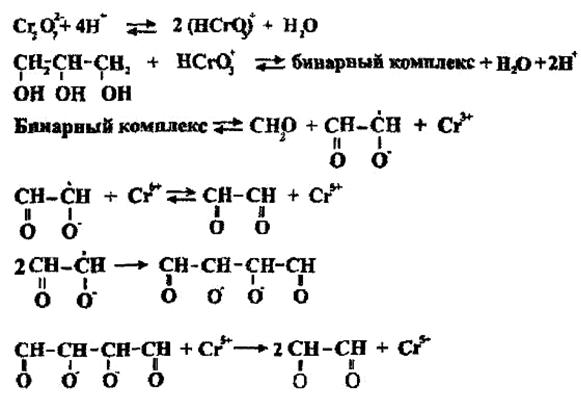 Предположено, что окисление
глицерина шестивалентным хромом может идти по следующему механизму
:
Предположено, что окисление
глицерина шестивалентным хромом может идти по следующему механизму
:
(1.7)
(1.8)
(1.9)
(1.10)
(1.11)
(1.12)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.