Мо2 О5 + 0,5О2 → 2МоО3 (1.4.8)
или
СН3ОН + 0,5О2 → СН2О + Н2О + 147,4 кДж/моль*
В основе превращения метанола на окисном контакте, как и на серебре, лежит реакция окислительного дегидрирования метанола. По существу единственной побочной реакцией данного процесса является дальнейшее окисление образовавшегося формальдегида. (См. ур. 1.4.3 и 1.4.4 ).
Лимитирующая стадия как основной, так и побочной реакции – взаимодействие метанола с поверхностным кислородом, собственно основной химический акт. Образующая вода оказывает тормозящее действие на обе реакции. Кроме того, метанол тормозит окисление формальдегида до оксида углерода и воды.
Окисные катализаторы менее чувствительны к примесям, чем серебряный и его аналоги.
Для поддержания активности катализатора реакцию необходимо проводить в избытке кислорода, поскольку в противном случае под действиемметанола и формальдегида катализатор быстро восстановится. Из этого, с учетом пределов взрываемости реакционных смесей, следует важнейшая особенность получения формальдегида на оксидных контактах: реакцию проводят при соотношении реагентов и воздуха ниже нижнего предела взрываемости, в данном случае при содержании метанола в исходной смеси не выше 7 – 8 %. Экспериментально было показано, что при температуре выше 400 оС катализатор теряет активность из – за уноса сравнительно летучих продуктов оксидов молибдена [17, стр. 62]. Также при повышении этого предела становятся ощутимыми потери формальдегида из – термического распада. С учетом этих соотношений, рабочая температура процесса поддерживается на уровне 350 – 390 оС.
За счет проведения процесса в кинетической области для основной реакции и высокой селективности оксидного контакта конверсия метанола может быть доведена до 98 – 99 %, при мольном выходе формальдегида на пропущенное сырье 95 – 96 %.
Ниже приведены основные показатели (таблица 1.9) работы промышленных агрегатов по получению формалина на оксидном катализаторе [21]:
Таблица 1.9 – Показатели агрегатов по получению формалина
|
Годовая производительность, тыс.т |
10 – 25 |
|
Массовая доля в формалине, % метанола, не более муравьиной кислоты, не более |
0,6 0,02 |
|
Массовая доля метанола в паровоздушной смеси на входе в реактор, % |
6 – 7 |
|
Расход (на 37 % формалина) электроэнергии, кВт·ч/т охлаждающей воды, м3/т |
160 25 – 28 |
|
Выход формалина, кг/(т·ч) |
1300 – 1600 |
|
Гидравлическое сопротивление реактора, МПа |
0,05 – 0,06 |
Рассматриваемый процесс приведен на рисунке 1.3 в виде технологической схемы, которая состоит из следующих узлов:
Компрессора 1; пяти теплообменников 2, 4 и 6; реактора
3; скруббера 5; сборника ф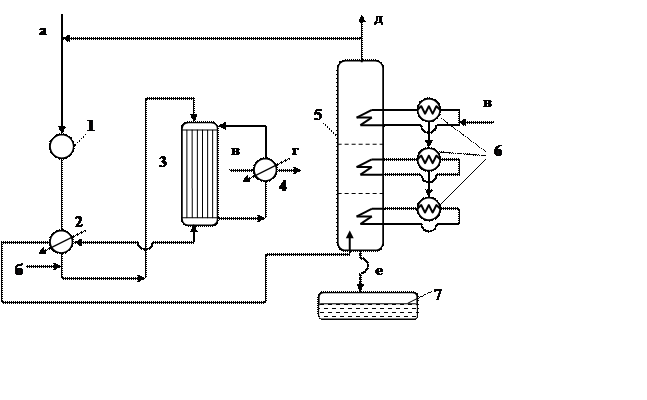 ормалина 7.
ормалина 7.
Рисунок 1.3 – Технологическая схема производства формальдегида на оксидном катализаторе
1 – компрессор; 2,4,6 – теплообменники; 3 – реактор; 5 – скруббер.
а – свежий воздух, б – метанол, в – вода, г – вторичный водяной пар, д – отработанный воздух, е – формалин.
На схеме производства формальдегида (рисунок 1.3) очищенный воздух с помощью воздуходувки подается в теплообменник 2 , где нагревается за счет тепла контактных газов. В трубопровод после теплообменника впрыскивается метанол. Нагретая до 180 оС спиртовоздушная смесь, содержащая 6 – 7 % (по массе) метанола, поступает в верхнюю часть реактора 3. Температура внутри трубок с катализатором составляет 360 – 380 оС, а в межтрубном пространстве 250 – 290 оС. Избыточное тепло реакции используется в теплообменнике 4 для получения вторичного пара. Контактный газ, охлажденный до 140 оС, из реактора направляется в нижнюю часть скруббера 5. Примерно одна треть газов после абсорбера поступает на факел, а оставшееся количество подается в рецикл. Из нижней части абсорбера выводится 37 % формалина.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.