Молекулярные состояния также как и атомные конфигурации имеют определённые обозначения, принятые у спектроскопистов: 2S+1Xg(u).Главный символ характеризует суммарный орбитальный момент количества движения (l). l показывает величину компоненты электронного момента количества движения относительно оси молекулы. Если l = 0, 1, 2, 3, то им соответствуют буквы S, P, D, Ф. Мультиплетность (2S + 1) вычисляется также как и в случае атомных термов. При этом расположение неспаренных электронов подчиняется правилу Гунда: низшее энергетическое состояние имеет большую мультиплетность. Нижний индекс “g” или “u” характеризует поведение полной волновой функции относительно инверсии в средней точке межядерной оси. При инверсии орбиталь u-типа меняет свой знак на противоположный, а g-типа остаётся неизменной. Например, для рассмотренных выше молекул Na2, F2, C2, N2, у которых все электроны спарены, имеют терм 1Sg+. У иона Na2+ терм 2Sg+, у F2+ - 2Pg, у N2+- 2Sg. Т.к. у гетероядерных молекул нет центра симметрии, то для них нижний индекс не указывается. Как следует из вышеизложенных положений, кратность связи не может быть более 3 (т.к. далее заполняются разрыхляющие орбитали). Простая (одиночная) связь - это s2; двойная - s2p2; тройная - s2p4. Это конечно не означает, что остальные электроны вовсе не играют никакой роли; просто они менее важны. Перекрывание АО, образующих p-связь, несколько меньше, чем образующих s-связь. Так для С=С (в этилене) отношение интегралов перекрывания для рs и рp » 2 : 1. Поэтому p-связь слабее s-связи, что и служит теоретическим объяснением высокой реакционной способности двойной связи. p-электроны легче разъединить и связать с другими приближающимися атомами. Представляет определённый интерес молекула кислорода, т.к. было установлено, что в отличие от других однокомпонентных газов, которые являются диамагнитными, кислород парамагнитен. Молекуле кислорода отвечает следующая электронная конфигурация:
О2[KK (s2s)2 (s*2s)2 (s2p)2 (p2p)4 (p*2p)2].
Здесь имеется 6 связывающих электронов (s2p)2(p2p)4 и два разрыхляющих (p*2p)2, что приводит к образованию двойной связи О=О. Однако, если оболочка из связывающих электронов заполнена полностью и все электроны там спарены, то на разрыхляющей оболочке только 2 электрона. Т.е. разрыхляющая оболочка p*2p заполнена не полностью. Согласно правилу Гунда электроны на этой оболочке распределяются таким образом, чтобы мультиплетность была максимальной. Поэтому эти два электрона займут разные орбитали: py*2p и pz*2p. Таким образом, основное состояние молекулы кислорода отвечает полному спину, равному единице (триплет, терм 3Sg-) и парамагнитно. Это объяснение было первым большим достижением теории молекулярных орбиталей.
![]() s*2р
s*2р
 |
p*2р
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() p2р
p2р
![]()
![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()
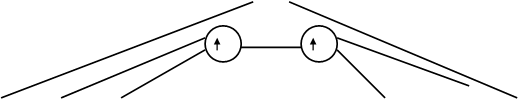
![]() 2px 2py 2pz
2pz 2py 2px
2px 2py 2pz
2pz 2py 2px
s2p
 |
![]()
![]()
![]()
![]()
![]()
![]()
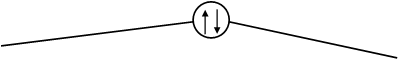
![]() s*2s
s*2s
2s s2s 2s
Атомные орбитали Молекулярные Атомные орбитали
орбитали
Рис.8.7. Энергетическая диаграмма для молекулы О2.
8.9. Двухатомные молекулы с разными ядрами.
Большинство двухатомных соединений построено из разных атомов (АВ) и имеют гетерополярную связь, в отличие от гомеополярной связи, которую имеют двухатомные молекулы с одинаковыми атомами (АА). Однако основные выводы, полученные для молекул АА применимы и для молекул АВ. Приближение ЛКАО даёт МО
Y = yА + lyВ.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.