Кратность связи в методе ВС даётся числом электронных пар с антипараллельными спинами по одному от каждого атома. Здесь о разрыхлении можно говорить только в смысле отталкивания между электронами, спины которых параллельны. Так в молекуле фтора F2 обычная связь образуется за счёт спаривания 2рх -электронов, тогда как 4 неподелённых электрона 2рy и 2рz отталкиваются друг от друга.
8.12.3. Возбуждённые состояния.
В методе ВС используются двухэлектронные волновые функции. При вычислении энергии связанных состояний получают два значения, одно из которых выше, а другое меньше любого из исходных состояний (правило непересечения). Минимальное значение энергии соответствует основному состоянию, а максимальное – возбуждённому.
Метод МО даёт возможность рассматривать свойства одного электрона, что удобно при рассмотрении возбуждённых состояний в спектроскопии молекул. Здесь переход в возбуждённое состояние – это переход на более высокую по энергии МО. Например, (s1s)2 ® (s1s)( s*1s) или (s1s)2 ® (s1s)(p2р). Эта особенность метода МО даёт ему преимущество при описании возбуждённых состояний, хотя и является упрощением (свойственным методу МО), ибо электронное возбуждение всегда в той или иной степени отражается на состоянии других электронов в молекуле (атоме).
8.12..4. Зарядовая плотность.
Оба метода предсказывают увеличение плотности заряда в пространстве между ядрами при образовании связи.
В соответствии с методом МО аналитическое выражение для электронной плотности каждого электрона молекулы водорода (основное состояние) таково:
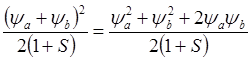 (8.12)
(8.12)
Т.о. полная электронная плотность от двух электронов пропорциональна величине
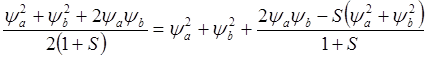 (8.13)
(8.13)
Из последнего выражения видно, что молекулярная электронная плотность превышает сумму плотностей двух свободных атомов (yA2 + yB2) в тех областях пространства, где произведение yAyB велико, а оно может быть большим лишь в межъядерном промежутке. Последний член правой части выражения 8.13 можно назвать “зарядом связи”. Образование химической связи сопровождается перемещением зарядового облака в пространство между ядрами. Поэтому размер молекулы всегда меньше суммы размеров атомов. Для разрыхляющей МО (с волновой функцией yA - yB) справедлив противоположный вывод.
В рамках метода ВС волновая функция имеет вид:
![]() ,
,
где N - нормировочный множитель:
![]() .
.
В соответствии с этим плотность заряда такова:
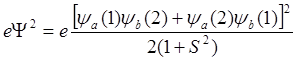 ,
(8.14)
,
(8.14)
которая определяет вероятность нахождения электрона 1 в точке с координатами (x1, y1, z1) и электрона 2 в точке с координатами (x2, y2, z2). Упуская промежуточные вычисления, полная электронная плотность для двух электронов в этом случае пропорциональна следующей величине:
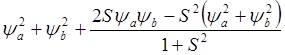 (8.15)
(8.15)
Сходство между формулами 8.13 и 8.15 очевидно, хотя из-за S < 1 выражение 8.13 приводит к несколько большему увеличению заряда в межъядерном промежутке, чем выражение 8.15. Т.о. простая связь представляет собой спаривание двух электронов, приводящее к увеличению вероятности нахождения электронов в межъядерном пространстве и снижению электронной плотности вне этого промежутка. По абсолютному значению заряд, сконцентрированный в пространстве между ядрами, невелик – 0.1 ¸ 0.25 заряда электрона. Но из-за того, что этот заряд близок к обоим ядрам потенциальная энергия системы понижается, что и приводит к образованию молекулы.
8.12.5. Полярность.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.