Таблица 8.1. Разрешённые и запрещённые по симметрии сочетания ya и yb.
|
Ya |
Yb |
|
|
разрешённые |
запрещённые |
|
|
s |
s px |
py pz dxy dxz dyz |
|
px |
s px |
py pz dxy dxz dyz |
|
Py |
py dxy dyz |
s px pz dx2
dxz |
|
dxy |
py dxy |
s pz dxz dyz |
|
|
s pz |
py pz dxy
dxz dyz |
|
|
s px
py |
pz dxy dxz dyz |
Соответственно этому электронная конфигурация основного состояния молекулы HCl выглядит следующим образом:
HCl [Cl 1s2 2s2 2px2 2py2 2pz2 3s2 3py2 3pz2][H1s + lCl 3px]2.
8.3. Молекулярный ион водорода Н2+.
Поскольку молекулаН2+ молекула одноэлектронная, задача её расчёта имеет такое же значение для теории молекул, какое имеет задача расчёта атома водорода для теории сложных атомов.
Пользуясь принципами метода ЛКАО построим из атомных орбиталей возможные молекулярные орбитали для Н2+:
![]() ,
,
где ya и yb одинаковые атомные орбитали, центры которых лежат на ядрах А и В. В силу симметрии задачи l2 = 1, l = ±1. Отсюда две разрешённые молекулярные орбитали:
![]() .
(8.3)
.
(8.3)
Применяя использованный нами ранее вариационный метод расчёта, получим соответствующие вековые (секулярные) уравнения и корни этих уравнений – значения энергии, соответствующие молекулярным орбиталям:
Е± =  , (8.4)
, (8.4)
или в более удобной форме:
Е± = Еa ± 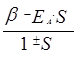 ,
(8.5)
,
(8.5)
где
Е = Еa = Еb, ![]() (резонансный интеграл),
(резонансный интеграл), ![]() (интеграл перекрывания). Как видно из
полученных выражений, первоначально вырожденный уровень (Еa = Еb) расщепляется, причём один из новых уровней
выше, а другой ниже первоначального. Величина расщепления определяется
значением резонансного интеграла b. Поскольку b отрицательно, то низшему уровню соответствует Е+.
При этом важно заметить, что из-за знаменателя 1 ± b расщепление не симметрично относительно исходного уровня: расстояние
от Еa до более высокого уровня превышает расстояние до более
низкого. Соответствующая ситуация представлена на рис. 8.2.
(интеграл перекрывания). Как видно из
полученных выражений, первоначально вырожденный уровень (Еa = Еb) расщепляется, причём один из новых уровней
выше, а другой ниже первоначального. Величина расщепления определяется
значением резонансного интеграла b. Поскольку b отрицательно, то низшему уровню соответствует Е+.
При этом важно заметить, что из-за знаменателя 1 ± b расщепление не симметрично относительно исходного уровня: расстояние
от Еa до более высокого уровня превышает расстояние до более
низкого. Соответствующая ситуация представлена на рис. 8.2.
|
Разрыхляющая Атомная YА АтомнаяYВ Связывающая |
Еa
Рис. 8.2. Образование молекулярных орбиталей из атомных.
В качестве конкретных атомных волновых функций,
составляющих молекулярную ВФ, выбираются низшие орбитали атома водорода – 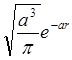 . Используя данную волновую функцию, вычисляют b и S для любого межядерного расстояния R. Затем вычисляют
зависимость энергии межядерного отталкивания (е2/R). На
основании этих данных получают кривую потенциальной энергии для молекулы. Эти
результаты представлены на рис.8.3.
. Используя данную волновую функцию, вычисляют b и S для любого межядерного расстояния R. Затем вычисляют
зависимость энергии межядерного отталкивания (е2/R). На
основании этих данных получают кривую потенциальной энергии для молекулы. Эти
результаты представлены на рис.8.3.
Энергия
молекулы, отвечающая симметричной волновой функции Y = ya +
yb,
имеет минимум при R » 2/ао. Для ![]() Е(R) не имеет минимума и в этом
случае ион Н2+ самопроизвольно распадается на Н + Н+.
Молекулярные орбитали, отвечающие первому случаю получили название связывающих,
а второму - разрыхляющих.
Е(R) не имеет минимума и в этом
случае ион Н2+ самопроизвольно распадается на Н + Н+.
Молекулярные орбитали, отвечающие первому случаю получили название связывающих,
а второму - разрыхляющих.
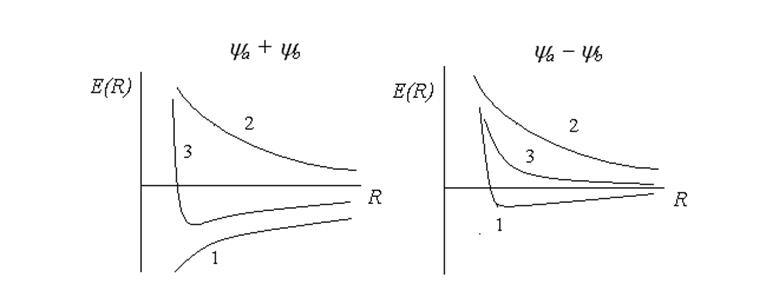
Рис.8.3. Кривые потенциальной энергии для Н2+. 1 – энергия электронного взаимодействия, 2 – энергия межъядерного отталкивания, 3 – полная энергия.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.