8.4. Связывающая и разрыхляющаяя МО.
1) Заряд, соответствующий связывающей МО, несколько сильнее сконцентрирован в пространстве между ядрами, чем этого можно было ожидать, если исходить из наложения атомных плотностей.
2) Протяжённость зарядового облака связывающей МО в направлении, перпендикулярном молекулярной оси, невелика, так что его эффективная толщина меньше межъядерного расстояния.
3) Заряд, соответствующий разрыхляющей МО вытолкнут из пространства между ядрами. Плоскость, проходящая через середину АВ и перпендикулярная к ней является узловой плоскостью.
4) Орбиталь ya + yb симметрична относительно центра молекулы, а орбиталь ya - yb - антисимметрична. Говорят также, что орбиталь ya + yb – чётная и отмечают её индексом g (gerade), а ya- yb – нечётная с индексом u (ungerade).
Т.о. образование химической связи для МО ya + yb связано с тем, что электрон концентрируется между ядрами и притягивает их друг к другу. Потенциальная энергия по абсолютной величине возрастает (имея отрицательный знак), а кинетическая энергия увеличивается в гораздо меньшей степени. В результате выигрыш в энергии превышает энергию ядерного отталкивания.
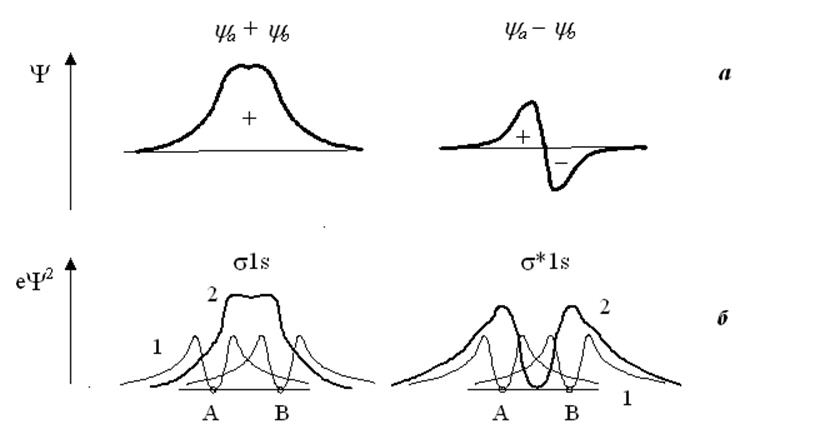
Рис.8.4. Изменение амплитуды волновой функции (а) и электронной плотности еY2 (б) вдоль межъядерной оси Н2+ в случае притяжения (s1s) и отталкивания (s*1s). Кривые 1 – для исходных атомов водорода, кривые 2 – для молекулы водорода.
В случае разрыхляющей МО электронная плотность между ядрами невелика и сил притяжения не достаточно для преодолевания ядерного отталкивания. Следует отметить, что использование для молекулы волновой функции в виде ЛКАО не обязательно. Было показано (Джеймс, 1935 г.), что весьма точные волновая функция и энергия для Н2+ могут быть получены на основе пробной функции вида:
Y = ![]() ,
,
в которой с1 и с2 - варьируемые параметры. В этом расчёте нет даже намёка на “квантово-механический резонанс”. Естественно, что кроме полученных нами низших (на основе 1s-орбитали) молекулярных орбиталей можно составить другие молекулярные орбитали, например, из 2s, 2pх и т.д. Эти МО соответствуют возбуждённым состояниям, часть из которых устойчива, а часть - нет. Молекула Н2+, находящаяся в неустойчивом состоянии, диссоциирует на протон и возбуждённый атом водорода, находящийся в состоянии 2s, 2pх и т.д., но не в основном состоянии.
8.5. Молекула водорода.
Большую часть сказанного об ионе Н2+ можно сказать и о молекуле Н2. Однако в последнем случае появляется второй валентный электрон. Естественно думать, что оба электрона занимают МО, сходную с орбиталью ya + yb молекулярного иона Н2+. Появление второго электрона приводит к возрастанию энергии связывания электронов с ядрами. В то же время эта энергия частично будет понижаться из-за межэлектронного отталкивания. Данные табл.8.2 дают возможность сравнить некоторые параметры Н2+ и Н2.
Таблица 8.2. Равновесные расстояния и энергии связи для Н2+ и Н2.
|
Параметры |
Расчёт по Хартри-Фоку |
Эксперимент |
|
|
Равновесное расстояние 1/а, ( |
Н2+ |
Н2 |
Н2 |
|
2.0 (1.06) |
1.5 (0.8) |
1.4 (0.74) |
|
|
Есв, эВ |
- 2.79 |
- 3.7 |
- 4.75 |
8.6. Двухатомные молекулы с одинаковыми ядрами.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.