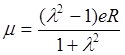 .
(8.9)
.
(8.9)
Аналогия с выражением 8.8 очевидна.
8.11. Типы молекулярных орбиталей.
Анализируя структуру двухатомных молекул с различными ядрами, можно сделать вывод, что электроны в таких молекулах могут занимать четыре типа орбиталей:
- орбитали внутренних оболочек;
- несвязывающие орбитали валентной оболочки;
- связывающие орбитали валентной оболочки;
- разрыхляющие орбитали валентной оболочки.
Например, у молекулы HСl (Н[1s], Cl [1s22s22p63s23p5]) электроны K и L оболочек, сильно локализованные около ядра хлора, относятся к первому типу. Это справедливо также и по отношению к 3s2-электронам. Связывающие МО валентных оболочек состоят из 1s водорода и 3px хлора (третий тип). В то же время АО Cl(3py)2 и Cl(3pz)2 не могут образовать никакой ЛКАО с водородом, поскольку энергия ближайшей орбитали водорода 2р, имеющей p-характер, настолько выше энергии орбиталей хлора 3р, что эффективная комбинация невозможна. Эти электроны хлора относятся ко второму типу. Такие спаренные электроны, занимающие валентную оболочку, называются неподелёнными.
8.12. Сравнение методов валентных связей и молекулярных орбиталей
Напомним, что в методе ВС предполагается, что достаточно учитывать лишь одну схему спаривания электронов (всеми остальными пренебрегают). Метод МО исходит из того, что одноэлектронные функции, удовлетворительные для атомов, в равной степени применимы и для молекул.
Следует отметить, что оба метода дают лишь приближённые результаты. Выполняя последовательный расчёт по методам ВС или МО получают ошибку в определении энергии в 1-2 эВ на связь. Из-за ограниченности вычислительных возможностей появляется ещё ошибка » 1 эВ. Таким образом получаемые результаты носят скорее качественный характер.
В качественной трактовке оба метода имеют много общего. Например, связывающие электроны принадлежат обоим ядрам. Однако выражается это по-разному. В случае метода ВС волновая функция записывается следующим образом:
![]() .
(8.10)
.
(8.10)
Из-за неразличимости электронов 1 и 2 они могут меняться местами. Т.е. электрон 1 может находиться как у атома А, так и у атома В.
В методе МО используют другую волновую функцию:
![]() .
(8.11)
.
(8.11)
Здесь для одного электрона записывается волновая функция, составленная из двух АО. МО – орбиталь двухцентровая.
Теперь обсудим подробнее как рассматривают некоторые вопросы теоретической химии тот и другой метод.
8.12.1. Спаривание электронов.
В методе ВС образование связи (спаривание электронов) происходит в соответствии с принципом Паули, т.е. описывается антисимметричной полной волновой функцией. Накопление отрицательного заряда в пространстве между ядрами, приводящего к образованию связи, возможно только при антисимметричной спиновой волновой функции (спины антипараллельны). При симметричной полной волновой функции спины параллельны. Поэтому электроны отталкиваются друг от друга и накопления заряда между ядрами не происходит.
При использовании метода МО вначале определяются дозволенные уровни энергии, а затем по ним распределяются электроны. По принципу Паули только 2 электрона могут занять один уровень (иметь одинаковые орбитальные волновые функции), но с разными спинами. МО образуются как бы из соединения АО. При этом в зависимости от способа соединения (от соотношения знаков волновых функций) образуются связывающие или разрыхляющие МО.
8.12.2. Кратность связи.
Одним из преимуществ метода МО является то, что учёт числа связывающих и разрыхляющих МО позволяет определить кратность связи. Здесь же следует отметить, что при удалении из молекулы “связывающего” электрона энергия диссоциации уменьшается, а при удалении “разрыхляющего” - увеличивается. Не так происходит с полной энергией молекулы: она при удалении любого электрона уменьшается.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.