Перед указанными обозначениями иногда ставят латинскую букву, указывающую на то из каких по уровню орбит образуется связь. Например, (k)ys соответствует первой и второй орбитам (s*1s), (m)wp отвечает третьей орбите (p3р).
8.7. Корреляционная диаграмма.
 Объёдинённый атом Молекулярная
орбиталь Разделённые атомы
Объёдинённый атом Молекулярная
орбиталь Разделённые атомы
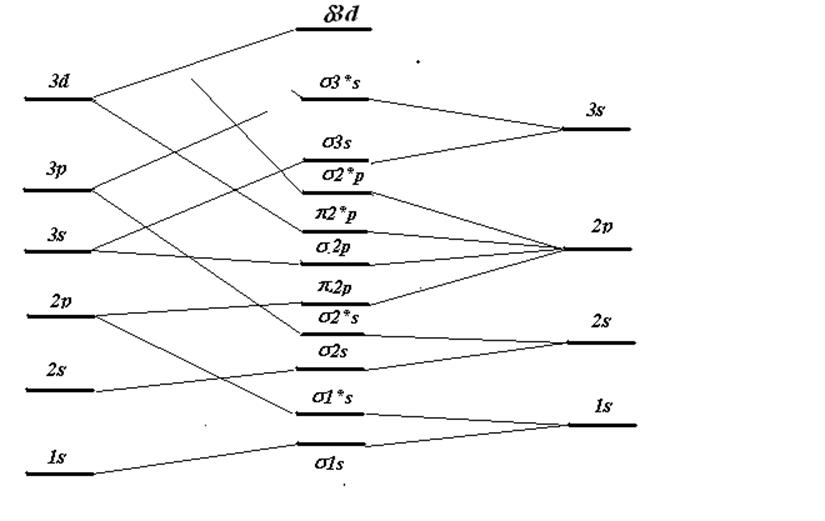
Рис.8.6. Корреляционная диаграмма для двухатомных молекул с одинаковыми ядрами.
Для понимания взаимосвязи между всеми МО в схеме их заполнения 8.6 интересно проследить в какую АО переходит МО при увеличении межатомного расстояния, а также обратный переход АО ® МО при слиянии двух ядер. Эти предельные конфигурации позволяют построить корреляционную диаграмму (рис.8.6), показывающую изменение энергии МО с изменением межядерного расстояния. В некоторых случаях (например, для возбуждённых состояний, называемых ридберговскими) молекулярные орбитали лучше представлять именно как АО объединённого атома, чем линейной комбинацией АО отдельных атомов. Из диаграммы следует, что уровни одинаковой симметрии (g, u) не пересекаются. Нетрудно также заметить, что все связывающие орбитали коррелируют с объединённым атомом, имеющим то же главное квантовое число, что и разъединённые атомы. Разрыхляющие же МО коррелируют с объединённым атомом, у которого главное квантовое число на одну или две единицы больше. Единственное исключение составляет s2р-орбиталь. Орбитали, которые повышают своё главное квантовое число в предельном случае объединённого атома, называются промотированнымиорбиталями. Наличие в молекуле заполненных промотированных орбиталей обычно препятствует образованию прочной химической связи.
Лекция 10
8.8. Электронная конфигурация. Принцип построения молекул. Молекулярный терм.
Молекула водорода имеет следующую электронную конфигурацию: (s1s)2 (одну связывающую МО). Ион гелия Не2+ – (s1s)2(s*1s). Молекула Не2 должна иметь (s1s)2(s*1s)2-конфигурацию. В молекуле гелия два электрона находятся на связывающей орбитали и два на разрыхляющей. Но энергия разрыхления превышает энергию связывания (см. рис. 8.2), поэтому молекула гелия образоваться не может. Ион же гелия Не2+ существует, так как на связывающей орбитали 2 электрона, а на разрыхляющей один. Жизнеспособность иона Не2+ доказана спектроскопическими данными. Следует отметить, что конфигурация заполненных МО типа (s1s)2(s*1s)2 не принимает активного участия в образовании молекулы. Квантово-механическая оценка распределения заряда в этом случае показывает, что две К-оболочки остаются совершенно неискажёнными в результате образования химической связи, какими они были в изолированных атомах. Поэтому при написании электронной конфигурации для молекул тяжелее, чем Не2 запись (s1s)2(s*1s)2 можно заменить на КК. То же самое можно сделать и в отношении L-оболочки. Например, для молекулы натрия электронная конфигурация записывается так:
Na2[KKLL(s3s)2].
Аналогично для молекулы фтора –
F2[KK (s2s)2 (s*2s)2(s2p)2 (p2p)4(p*2p)4] или
F2[KK(zs)2(ys)2(xs)2(wp)4(vp)4]
Анализируя приведённые примеры, можно сказать, что в молекуле натрия из 14 валентных электронов связь определяет фактически только МО (s3s)2 или ((m)xs)2; в молекуле фтора (s2p)2. В молекуле углерода кратность связи 2:
С2[KK (s2s)2 (s*2s)2 (p2p)4 ].
Связь в молекуле азота определяется 6 электронами, т.е. тройная. Однако связи неравноценны. Одна связь осуществляется парой s-электронов, а две других – двумя парами p-электронов:
N2[KK (s2s)2 (s*2s)2 (p2p)4(s2p)2 ].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.