При этом для скорости спин-спиновой релаксации (1/Т2) сигнала ЯМР ОН-группы енола или сигнала СН2‑группы кетона справедливо соотношение
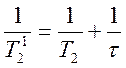 (9.18)
(9.18)
Здесь ![]() – скорость релаксации при отсутствии
обмена,
– скорость релаксации при отсутствии
обмена, ![]() – наблюдаемая скорость релаксации при
наличии обмена; t – время жизни
протона в кето- или енольной форме ацетилацетона, величина
– наблюдаемая скорость релаксации при
наличии обмена; t – время жизни
протона в кето- или енольной форме ацетилацетона, величина ![]() равна константе скорости реакции k1 или k2.
Так как величина Т2 связана с шириной линии ЯМР соотношением
равна константе скорости реакции k1 или k2.
Так как величина Т2 связана с шириной линии ЯМР соотношением
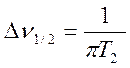 , (9.19)
, (9.19)
то выражение (9.6) можно представить в виде
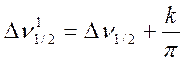 (9.20)
(9.20)
Здесь ![]() – ширина линии OH-группы
енола или СН2-группы кетона при отсутствии обмена;
– ширина линии OH-группы
енола или СН2-группы кетона при отсутствии обмена; ![]() – та же величина, но при наличии обмена
между кето- и енольными формами ацетилацетона.
– та же величина, но при наличии обмена
между кето- и енольными формами ацетилацетона.
В первом приближении можно считать, что ![]() равна
ширине ОН- или СН2-линий ацетилацетона при отсутствии добавок
диэтиламина. Вычитая ширину линий ОН или СН2 ацетилацетона без
добавок диэтиламина из ширины этих линий, но в присутствии добавок диэтиламина,
можно определить константы скорости обмена кето- и енольной форм ацетилацетона,
а анализируя температурную зависимость
равна
ширине ОН- или СН2-линий ацетилацетона при отсутствии добавок
диэтиламина. Вычитая ширину линий ОН или СН2 ацетилацетона без
добавок диэтиламина из ширины этих линий, но в присутствии добавок диэтиламина,
можно определить константы скорости обмена кето- и енольной форм ацетилацетона,
а анализируя температурную зависимость ![]() , легко
получить значение энергии активации реакций превращения кето-формы
ацетилацетона в енольную форму и наоборот.
, легко
получить значение энергии активации реакций превращения кето-формы
ацетилацетона в енольную форму и наоборот.
Методика проведения эксперимента
1. Приготовить два образца в 5 мм ампулах ЯМР:
А: 0,5 мл ацетилацетона + 0,025 мл ГМДС или ТМС;
Б: 0,3 мл ацетилацетона + 0,2 мл диэтиламина + 0,025 мл ГМДС.
2. Записать спектры ЯМР двух образцов и сделать отнесение сигналов к кето- и енольной формам при T = 294 К.
3. Измерить ширины линий ОН- и СН2-групп ацетилацетона без добавок диэтиламина (образец "А") и считать, что она не меняется при изменении температуры.
4. Измерить ширины линий ОН- и СН2-групп ацетилацетона в присутствии диэтиламина (образец "Б").
5. Определить k1 и k2 по формуле (9.20).
6. Увеличить температуру на 5‑6 градусов и вновь измерить ширины линий, определить k1 и k2.
7. Получить
7‑10 значений ![]() для кето- и енольной форм до
температуры »340 К и в каждом
случае определить k1 и k2.
для кето- и енольной форм до
температуры »340 К и в каждом
случае определить k1 и k2.
8. Результаты оформляют в виде таблицы:
|
T, K |
|
|
k1 |
k2 |
9. Строят
линейную анаморфозу (lnk; 1/Т) и
обрабатывают ее по методу наименьших квадратов (выражения (9.4)-(9.6)).
Получают значения энергии активации Е1 и Е2
и величины предэкспоненциальных множителей ![]() и
и ![]() , а также значения ошибок для Е1,
Е2,
, а также значения ошибок для Е1,
Е2, ![]() и
и ![]() . Результаты
заносят в таблицу:
. Результаты
заносят в таблицу:
|
Е1 |
|
Е2 |
|
|
|
|
|
ЛАБОРАТОРНАЯ РАБОТА Я-5
Определение скорости и энергии активации диссоциации бипиридината бис(ацетилацетоната) никеля(II) Ni(асас)2Ру2
Процесс координации пиридина (Ру) к комплексу Ni(acac)2Py2 описывается уравнением
M + L ↔ ML,
где М = Ni(асас)2Ру2, L = Ру, К – константа устойчивости, определяемая как:
K = 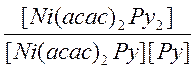 >> 102
>> 102
Обмен Ру между раствором и координационной сферой Ni(II) является быстрым в шкале времени ЯМР. В соответствии с этим парамагнитный сдвиг ядер Ру определяется выражением
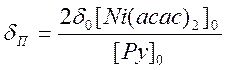 , (9.21)
, (9.21)
а ширина линии по уравнению (7.4), где состояния А и В относятся к координированному и свободному состояниям Ру соответственно.
Для выполнения измерений времен обмена и энергий активации необходимо измерить парамагнитный сдвиг и ширину линии a‑протона Ру в диапазоне температур от 30 до 70 °С. Из этих данных можно найти kдис. и Eдис., если в свободном состоянии хим. сдвиг Ру составляет 516 Гц, а ширина линии a‑протона равна 2 Гц.
Методика выполнения эксперимента
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.