Со(асас)2Ру2 + СН2С12 ↔ [Co(acac)2Py2]·CH2Cl2 (9.15)
Парамагнетизм Со(асас)2Ру2 приводит к тому, что линия СН2Сl2 в комплексе с Со(асас)2Ру2 должна быть сдвинута на 28 м.д. в слабое поле по сравнению с сигналом свободного СН2Сl2. Однако, поскольку имеет место быстрый в шкале времени ЯМР обмен молекулы СН2Сl2 между координированным и свободным состояниями, в спектре ЯМР наблюдается одна линия, положение которой будет зависеть от соотношения концентраций в растворе СН2Сl2 и [Со(асас)2Ру2]·СН2Сl2.
При выполнении условия [Со(асас)2Ру2] << [СН2Сl2] для величины наблюдаемого парамагнитного сдвига СН2Сl2 справедливо следующее выражение:
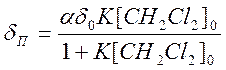 (9.16)
(9.16)
где ![]() – разность сдвигов линии ЯМР СН2Сl2 в присутствии Со(асас)2Py2 в растворе и в его отсутствие (диамагнитный растовор);
a = [Со(аcас)2Ру2]0/[CH2Cl2]0;
d0 – величина
парамагнитного сдвига СН2Сl2 в
комплексе с Со(асас)2Ру2, d0 = 28 м.д.
– разность сдвигов линии ЯМР СН2Сl2 в присутствии Со(асас)2Py2 в растворе и в его отсутствие (диамагнитный растовор);
a = [Со(аcас)2Ру2]0/[CH2Cl2]0;
d0 – величина
парамагнитного сдвига СН2Сl2 в
комплексе с Со(асас)2Ру2, d0 = 28 м.д.
Величина константы равновесия К для реакции (9.15) К » 3 М−1. Тогда при концентрации [СН2Сl2] » 0,1 М будет справедливо соотношение K·[CH2Cl2] << 1, и выражение (9.16) можно переписать как
![]() (9.17)
(9.17)
Из выражения (9.17), зная величины a,
d0, [СН2Сl2]0, по экспериментально определяемому
параметру ![]() легко получить точное значение К. Величина
K связана с изменением термодинамических
потенциалов соотношением (9.3).
легко получить точное значение К. Величина
K связана с изменением термодинамических
потенциалов соотношением (9.3).
Таким образом, определяя из эксперимента величину парамагнитного сдвига ![]() при фиксированной температуре, можно
получить температурную зависимость константы равновесия К для реакции
(9.15), а затем вычислить параметры
при фиксированной температуре, можно
получить температурную зависимость константы равновесия К для реакции
(9.15), а затем вычислить параметры ![]() и
и ![]() .
.
Методика проведения эксперимента
1. Готовят два раствора в С6H12 объемом 0,6 мл:
образец А: [Со(асас)2]0 = 2×10−3M; [Py]0 = 0,05 M; [СН2Сl2]0 = 0,1 М;
образец Б: [СН2Сl2]0 = 0,1 М; [Py]0 = 0,05 M.
Добавляют в оба раствора по ~0,05 мл внутреннего эталона ГМДС или ТМС.
2. Записывают спектр ЯМР образца А при фиксированной температуре (T = 25 °С), измеряют расстояние в герцах между линиями СН2Сl2 и С6Н12.
3. Записывают спектр образца Б и вновь измеряют расстояние между линиями СН2Сl2 и С6Н12. Разность расстояний между линиями образца А и Б представляет собой парамагнитный сдвиг.
4. Повышают температуру на 6‑8 °С и вновь записывают спектр ЯМР двух
образцов и вычисляют величину ![]() .
.
5. Получают зависимость К = f(Т) в 5‑10 точках до температуры 75 °С.
6. Вычисляют величины К по формуле (9.16) при каждой температуре.
7. Строят линейную зависимость RlnK от 1/Т по методу наименьших квадратов
(9.4). Из отсекаемого отрезка и тангенса угла наклона зависимости R1nК от 1/Т
получают величины ![]() и
и ![]() и
определяют величины стандартных отклонений
и
определяют величины стандартных отклонений ![]() и
и ![]() по формулам (9.4)-(9.6).
по формулам (9.4)-(9.6).
В этих формулах y = RlnK;
x = 1/T; p =
![]() ; q =
; q = ![]() ;n – число точек в эксперименте.
;n – число точек в эксперименте.
8. Результаты заносят в таблицу
|
T, K |
K, M−1 |
|
|
|
|
ЛАБОРАТОРНАЯ РАБОТА Я-4
Определение кинетических параметров процесса кето-енольной таутомерии ацетилацетона в присутствии диэтиламина
Процесс кето-енольной таутомерии ацетилацетона можно рассматривать как перенос протона согласно реакции (9.1). В отсутствие каких-либо добавок время жизни каждого из состояний весьма велико (несколько секунд, k1 и k2 – малы, и в спектре ЯМР 1Н наблюдаются две группы линий, относящиеся к протонам кето- и енольных форм. Добавление диэтиламина в ацетилацетон приводит к ускорению прямой и обратной реакции (9.1). При этом в спектре ЯМР наблюдается слияние сигналов СН3‑групп и уширение ОН‑сигнала енола и СН2‑сигнала кето-формы, а также их сдвиг навстречу друг другу.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.